配位平衡也是一种相对平衡状态,存在着平衡移动,它同溶液的pH值、沉淀的反应、氧化还原反应等有密切关系,也就是说,在溶液中形成配位物时,常常出现颜色的变化、溶解度的变化、PH值的改变等现象.Br
-与Cu
2+反应生成配位化合物,就存在配位平衡. Cu
2++2Br
-?Cu Br
2Cu
2++4Br
-?[Cu Br
4]
2-已知:Cu
2+在水溶液中显蓝色,[Cu Br
4]
2-在水溶液中显黄色,蓝色与黄色并存时显绿色,[Cu Br
4]
2-浓度越大,颜色越深.同时,温度可能对[Cu Br
4]
2-的稳定性有影响.
某化学探究小组的同学为了探究温度、浓度对Br
-与Cu
2+的配位平衡的影响,于是做了下列的假设与猜想(填写空缺的假设):
[假设与猜想]
1、增大配位离子(Br
-)的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;
2、
增大Cu2+的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;
增大Cu2+的浓度,平衡向正反应方向移动,生成配合物的浓度增大,溶液颜色加深;
.
3、温度变化可能影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动.
4、温度变化也可能使化学平衡向左移动,抑制配合物的形成.
[实验准备]
(1)CuSO
4溶液的准备:分别取3份8g无水CuSO
4固体,各加入水稀释到100ml、50ml、25ml(第三种溶液已饱和);
(2)NaBr溶液的准备:分别取2.06g、4.12g、4.12gNaBr晶体,各加入水稀释到50ml、50ml、25ml.
问题1:粗略配制上述溶液需要用到的仪器有:
(托盘)天平、烧杯、玻璃棒、量筒
(托盘)天平、烧杯、玻璃棒、量筒
;
表1、不同浓度的Br
-溶液与某一浓度的Cu
2+溶液反应
| 编号 |
5mlCu2+溶液(mol?L-1) |
10ml Br-溶液(mol?L-1) |
现象 |
| ① |
第一份CuSO4溶液 |
a |
溶液由蓝色变为蓝绿色 |
| ② |
第一份CuSO4溶液 |
b |
溶液由蓝色变为草绿色 |
| ③ |
第一份CuSO4溶液 |
c |
溶液由蓝色变为亮绿色 |
表2、不同浓度的Cu
2+溶液与某一浓度的Br
-溶液反应
| 编号 |
5mlCu2+溶液(mol?L-1) |
10ml Br-溶液(mol?L-1) |
现象 |
| ① |
d |
第一份NaBr溶液 |
溶液由蓝色变为蓝绿色 |
| ② |
e |
第一份NaBr溶液 |
溶液由蓝色变为草绿色 |
| ③ |
f |
第一份NaBr溶液 |
溶液由蓝色变为亮绿色 |
表3、不同温度对配合物形成的影响
| 编号 |
5mlCu2+溶液(mol?L-1) |
10ml Br-溶液(mol?L-1) |
温度 |
现象 |
| ① |
第一份CuSO4溶液 |
第一份NaBr溶液 |
25℃ |
溶液由蓝色变为蓝绿色 |
| ② |
第一份CuSO4溶液 |
第一份NaBr溶液 |
60℃ |
溶液由蓝色变为草绿色 |
| ③ |
第一份CuSO4溶液 |
第一份NaBr溶液 |
75℃ |
溶液由蓝色变为亮绿色 |
问题2:上表中b=
0.8
0.8
mol/L,e=
1.0
1.0
mol/L;
问题3:通过表3得出的结论是
温度升高影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动.
温度升高影响配合物的稳定性,促进配合物的形成,平衡向正反应方向移动.
;
问题4:上述反应根据的原理是
勒沙特列原理(或化学平衡移动原理).
勒沙特列原理(或化学平衡移动原理).
.

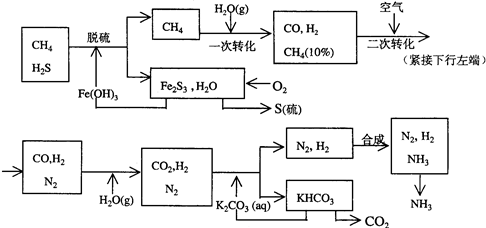
 合成氨工业对国民经济和社会发展具有重要的意义.其原理为:
合成氨工业对国民经济和社会发展具有重要的意义.其原理为: