
题目列表(包括答案和解析)
浓度与反应速率的关系
c(H2)/mol·L-1 | c(Cl2)/mol·L-1 | v/mol·L-1·s-1 |
1.0 | 1.0 | 1.0k |
2.0 | 1.0 | 2.0k |
2.0 | 4.0 | 4.0k |
由此可以推出,m、n的值正确的是( )?
A.m=1,n=1? B.m=![]() ,n=
,n=![]()
C.m=![]() ,n=1 D.m=1,n=
,n=1 D.m=1,n=![]()
| 温度/ | 500 | 700 | 900 |
| K | 1.00 | 1.47 | 2.40 |
2- 3 |
- 3 |
2- 3 |
- 3 |
- 3 |
2- 3 |
2- 3 |
- 3 |
化学反应速率与反应物浓度的关系式(称为速率方程)是通过实验测定的,以反应aA+Dd![]() eE为例,可先假设该反应的速率方程为v=kcm(A)cn(D),然后通过实验测得的数据,算出k、m、n的值,再将k、m、n的值代入上式,即得速率方程.现测得25℃时溶液中的反应3X+2Y
eE为例,可先假设该反应的速率方程为v=kcm(A)cn(D),然后通过实验测得的数据,算出k、m、n的值,再将k、m、n的值代入上式,即得速率方程.现测得25℃时溶液中的反应3X+2Y![]() 2Z在不同浓度时的反应速率如下表:
2Z在不同浓度时的反应速率如下表:
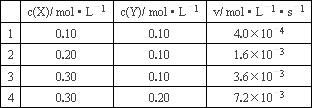
根据以上实验数据,完成下列问题:
(1)上述反应在25℃时的速率方程为v=________.
(2)当c(X)=c(Y)=0.25 mol·L-1时,v=________.
某化学反应2A![]() B + D在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示。
B + D在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示。

根据上述数据,回答下列问题:
(1)在实验1中,0~10min内的反应速率v(A)为 mol??L-1????min-1。
(2)与实验1相比,实验2的反应速率更 (填“快”或“慢”),其原因可能是 。
(3)根据实验1和实验3的数据分析升温对该反应的影响,写出两条结论:① ;
② 。
(4)实验4只改变温度,其它条件不变。请在答题卡的相应位置画出实验1和实验4的“浓度—时间”关系曲线。
 www.k@s@5@u.com
www.k@s@5@u.com
某化学反应2AB + D在不同条件下进行,B、D的起始浓度为0,把反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表所示。
根据上述数据,回答下列问题:
(1)在实验1中,0~10min内的反应速率v(A)为 mol•L-1••min-1。
(2)与实验1相比,实验2的反应速率更 (填“快”或“慢”),其原因可能是 。
(3)根据实验1和实验3的数据分析升温对该反应的影响,写出两条结论:① ;
② 。
(4)实验4只改变温度,其它条件不变。请在答题卡的相应位置画出实验1和实验4的“浓度—时间”关系曲线。
www.k@s@5@u.com
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com