
题目列表(包括答案和解析)
过氧化氢水溶液俗称双氧水,沸点比水高,遇光、热及重金属化合物等均能引起分解。
(1)某试剂厂先制得7%~8%的双氧水,欲将其浓缩成30%的溶液,适宜方法是
(填写编号)。
a.常压蒸馏 b.减压蒸馏 c.加入生石灰常压蒸馏 d.加压蒸馏
(2)如果得到的双氧水中氧元素的含量为90%,则过氧化氢的纯度为 。众所周知,氢气在空气中燃烧生成水。有人提出,氢气在空气中燃烧也可能生成H2O2,但它因高温而分解了。为了验证氢气在空气中燃烧的产物中是否含有H2O2,某课外小组同学设计的实验装置见图-1。

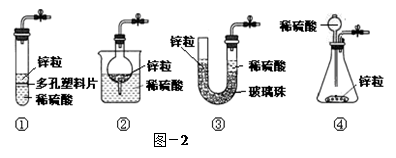
(3)甲同学想从下图-2的①-④中选取替代图-1方框中的装置,可行的是 (填写编号)。

(4)若乙同学用酸性高锰酸钾溶液检测到了H2O2的存在,完成该反应的离子方程式:
→ + Mn2+ + H2O
丙同学对乙的检验方案提出了质疑:若锌粒与稀硫酸的反应中产生了少量H2S等还原性气体,也会使酸性高锰酸钾溶液褪色。请对乙同学的实验方案提出改进建议: 。
(5)过碳酸钠(2Na2CO3•3H2O2)俗称固体双氧水,极易分解,其分解反应的化学方程式可表示为:2 (2Na2CO3•3H2O2) → 4Na2CO3 + 6H2O + 3O2↑
取一定量的过碳酸钠在密闭容器中使它完全分解,测得生成氧气12.0g。冷却到室温后,向所得产物中加水配制成10.6% 的Na2CO3溶液,需加水 g。
过氧化氢水溶液俗称双氧水,沸点比水高,遇光、热及重金属化合物等均能引起分解。
(1)某试剂厂先制得7%~8%的双氧水,欲将其浓缩成30%的溶液,适宜方法是
(填写编号)。
a.常压蒸馏 b.减压蒸馏 c.加入生石灰常压蒸馏 d.加压蒸馏
(2)如果得到的双氧水中氧元素的含量为90%,则过氧化氢的纯度为 。众所周知,氢气在空气中燃烧生成水。有人提出,氢气在空气中燃烧也可能生成H2O2,但它因高温而分解了。为了验证氢气在空气中燃烧的产物中是否含有H2O2,某课外小组同学设计的实验装置见图-1。
(3)甲同学想从下图-2的①-④中选取替代图-1方框中的装置,可行的是 (填写编号)。
(4)若乙同学用酸性高锰酸钾溶液检测到了H2O2的存在,完成该反应的离子方程式:
→ + Mn2+ + H2O
丙同学对乙的检验方案提出了质疑:若锌粒与稀硫酸的反应中产生了少量H2S等还原性气体,也会使酸性高锰酸钾溶液褪色。请对乙同学的实验方案提出改进建议: 。
(5)过碳酸钠(2Na2CO3?3H2O2)俗称固体双氧水,极易分解,其分解反应的化学方程式可表示为:2 (2Na2CO3?3H2O2) → 4Na2CO3 + 6H2O + 3O2↑
取一定量的过碳酸钠在密闭容器中使它完全分解,测得生成氧气12.0g。冷却到室温后,向所得产物中加水配制成10.6% 的Na2CO3溶液,需加水 g。

 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 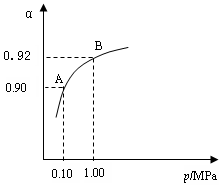
 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1 2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。
2SO2+O2 在550 ℃时的平衡常数K=_________。 A、B表示不同压强下的平衡转化率,通常工业生产中采用常压的原因是:__________________,并比较不同压强下的平衡常数:K(0.10 MPa) _________K(1.0 MPa)(填 “<”或“>”或“=”)。 

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com