
题目列表(包括答案和解析)
已知:①FeS不溶解于水;②实验室制取H2S、SO2气体的原理是:
FeS+H2SO4=FeSO4+H2S↑
Na2SO3+H2SO4=Na2SO4+H2O+SO2↑;
③硫化氢与二氧化硫气体相遇会发生反应:2H2S+SO2=3S+2H2O.
根据下图中A~D的实验装置和试剂进行实验,回答下列问题:
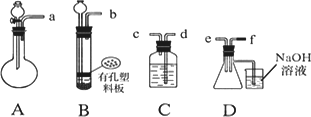
(1)装置A是由双孔塞、玻璃导管及________和________组装起来的.
(2)组装一套制取SO2气体的装置,并证明SO2既有氧化性、又有还原性和漂白性.
①按实验装置连接顺序,把a→f各导管口连接起来,正确的顺序有________.
A.befcda
B.adcefb
C.acdfeb
D.acdefb
②若C装置中的溶液为________,反应后该溶液变为无色,说明SO2具有还原性;?
③若C装置中的溶液为________,反应后该溶液变为无色,说明SO2具有漂白性;
④当D中产生________现象时,说明SO2具有氧化性;
(3)D装置烧杯中NaOH溶液的作用________.
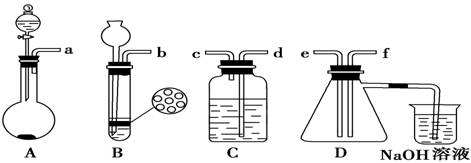
已知实验室制取H2S的实验原理为FeS(块状)+H2SO4===FeSO4+H2S↑。根据下图中A~D 的实验装置和试剂进行实验:
(1)装置A是由双孔塞、玻璃导管、________和________组装起来的。
(2)组装一套制取二氧化硫气体的装置,并证明二氧化硫既有氧化性又有还原性:

制备SO2的实验原理:Na2SO3(粉末状)+H2SO4(70%)===Na2SO4+SO2↑+H2O。
①按实验装置连接顺序:把a→f各导管口连接起来,正确的顺序是___________。
②C装置中的溶液是 ,说明二氧化硫具有 性。
(3)D中产生的现象是 ,说明二氧化硫具有 性。
(4)烧杯中发生反应的离子方程式为________________________。
已知实验室制取H2S的实验原理为FeS(块状)+H2SO4===FeSO4+H2S↑。根据下图中A~D 的实验装置和试剂进行实验:
(1)装置A是由双孔塞、玻璃导管、________和________组装起来的。
(2)组装一套制取二氧化硫气体的装置,并证明二氧化硫既有氧化性又有还原性:
制备SO2的实验原理:Na2SO3(粉末状)+H2SO4(70%)===Na2SO4+SO2↑+H2O。
①按实验装置连接顺序:把a→f各导管口连接起来,正确的顺序是___________。
②C装置中的溶液是 ,说明二氧化硫具有 性。
(3)D中产生的现象是 ,说明二氧化硫具有 性。
(4)烧杯中发生反应的离子方程式为________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com