
题目列表(包括答案和解析)
| A、pH相等的CH3COONa、NaOH和Na2CO3三种溶液浓度大小关系为:c(NaOH)<c(CH3COONa)<c(Na2CO3) | B、0.1mol/L NaHA溶液的pH=4,该溶液中c(HA-)>c(H+)>c(H2A)>c(A2-) | C、两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2 | D、pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色 |
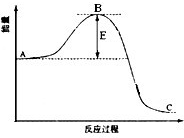 合成氨反应过程中的能量变化如图所示,据图回答下列问题:
合成氨反应过程中的能量变化如图所示,据图回答下列问题:| [NH3]2 |
| [N2][H2]3 |
| [NH3]2 |
| [N2][H2]3 |
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| NH3的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应物转化率 | a1 | a2 | a3 |
 CH3OH(g)△H
CH3OH(g)△H| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
| V2 |
| a2 |
| V2 |
| a2 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1molCO、2moL H2 | 1molCH3OH | 2molCH3OH | |
| 平 衡 时 的 数 据 |
CH3OH浓度(mol/L) | c1 | c2 | c3 |
| 反应的能量变化 | akJ | bkJ | ckJ | |
| 体系压强(Pa) | p1 | p2 | p3 | |
| 反应物转化率 | α1 | α2 | α3 | |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com