
题目列表(包括答案和解析)
某学校化学课外小组用已知浓度的盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题.
①应选择________作指示剂.
②为减小滴定误差,在选用盐酸的物质的量浓度和体积时,下列四个选项中最佳的是________(填选项字母)
(A)1 mol/L,50 mL
(B)0.20 mol/L,25 mL
(C)0.02 mol/L,5 mL
(D)5 mol/L,10 mL
③现有用浓盐酸新配制出的溶液,该盐酸在使用前,欲标定其准确的浓度,需用基准物进行标定.已知基准物是某些纯度高、稳定性好的物质,可在准确称量后直接配制成标准溶液并标定其它溶液的浓度.实验室标定标准的盐酸一般选用纯净的无水碳酸钠作基准物.上述基准物能否改用纯净的氢氧化钠固体?________(填“能”或“不能”);简述理由________.
| |||||||||||||||||||
(12分)某学生在实验室测定一未知浓度的稀盐酸,已知在25ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示: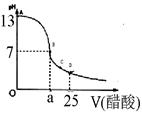
(1)该氢氧化钠溶液的物质的量浓度为 mol.L—1
(2)在B点,a 12.5ml(填“>”、“<”或“="”" )。
(3)配制100 mL NaOH标准溶液所需仪器除托盘天平、玻璃棒、胶头滴管外,还需要
(4)用 量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com