
题目列表(包括答案和解析)
 某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”.由化学手册查阅得有关物质的熔、沸点数据如下表.
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”.由化学手册查阅得有关物质的熔、沸点数据如下表.| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 |
- 3 |
- 3 |
- 3 |
- 3 |
(14分)高铁酸钾(K2FeO4)是一种集氧化、吸附、
絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新
型、高效、绿色环保的多功能水处理剂。近十几年
来,我国对高铁酸钾在饮用水处理中的应用的研究
也不断深入,已取得可喜成果。比较理想的制备方
法是次氯酸盐氧化法:先向KOH溶液中通入足量
Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,
得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾。
(1)向次氯酸钾强碱饱和溶液中加入三价铁盐发生反应的离子方程式:
①Fe3++3OH-=Fe(OH)3;② 。
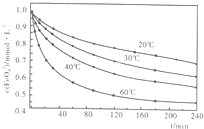
(2)高铁酸钾溶于水能释放大量的原子氧,从而非常有效地杀灭水中的病菌和病毒,与此同时,自身被还原成新生态的Fe(OH)3,这是一种品质优良的无机絮凝剂,能高效地除去水中的微细悬浮物。将适量K2Fe2O4溶液于pH=4.74的溶液中,配制成c(FeO2-4) =1.0mmol·L-1试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(FeO2-4)的变化,结果见下图。高铁酸钾与水反应的离子反应方程式为 ,该反应的△H 0(填“>”“<”或“=”)。
(3)高铁酸盐还是一类环保型高性能电池的材料,用它做成的电池能量高,放电电流大,能长时间保持稳定的放电电压。高铁电池的总反应为:
 |
 高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾.
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝、杀菌、灭菌、去浊、脱色、除臭为一体的新型、高效、绿色环保的多功能水处理剂.近十几年来,我国对高铁酸钾在饮用水处理中的应用的研究也不断深入,已取得可喜成果.比较理想的制备方法是次氯酸盐氧化法:先向KOH溶液中通入足量Cl2制备次氯酸钾饱和溶液,再分次加入KOH固体,得到次氯酸钾强碱性饱和溶液,加入三价铁盐,合成高铁酸钾. 3Zn(OH)3+2Fe(OH)3+4KOH该电池放电时的负极反应式为______,若外电路有5.418×1022个电子通过,则正极有______g高铁酸钾参与反应.
3Zn(OH)3+2Fe(OH)3+4KOH该电池放电时的负极反应式为______,若外电路有5.418×1022个电子通过,则正极有______g高铁酸钾参与反应.| 放电 |
| 充电 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com