
题目列表(包括答案和解析)
| X |
| X |
| H2O |
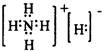
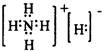
| H | + 4 |
| O | 2- 3 |
| O | 2- 3 |
| O | 2- 4 |
| O | - 2 |
| O | - 3 |
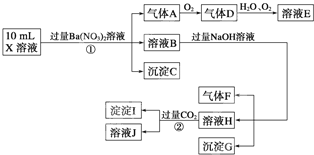
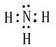
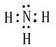
 (2013?防城港二模)某混合溶液中,可能大量含有的离子如下表:
(2013?防城港二模)某混合溶液中,可能大量含有的离子如下表:| 阳离子 | H+、K+、Al3+、NH4+、Mg2+ |
| 阴离子 | OH-、SO42-、CO32-、AlO2- |
| 离子种类 | H+ H+ |
Al3+ Al3+ |
NH4+ NH4+ |
Mg2+ Mg2+ |
SO42- SO42- |
|
| 物质的量(mol) | 2 2 |
2 2 |
2 2 |
3 3 |
≥8 ≥8 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com