
题目列表(包括答案和解析)
|
硫的非金属性弱于氯的主要事实是 | |
| [ ] | |
A. |
通常状况下硫为浅黄色固体,而氯为黄绿色气体 |
B. |
硫不溶于水而氯气能溶于水 |
C. |
跟金属反应和氯气反应时,硫被还原为-2价,氯被还原为-1价 |
D. |
跟同一种金属(如Cu或Fe)反应时,金属被硫氧化成低价态,被氯氧化成高价态 方法技巧:熟练掌握元素非金属性强弱比较方法. |

类推的思维方法是化学学习和研究中常用的重要思维方法,但所得结论要经过实践的检验才能确定其正确与否。根据你所掌握的知识,判断下列类推结论中正确的是( )
化学事实 类推结论
A pH=3的盐酸稀释1000倍后pH=6 pH=6的盐酸稀释1000倍后pH=9
B 电解熔融MgCl2的可制取金属镁 用电解熔融NaCl的方法也可制取金属钠
C 将SO2通入BaCl2溶液中无沉淀生成 将SO2通入Ba(NO3)2溶液中也无沉淀生成
D Al在O2中燃烧生成Al2O3 Fe在O2中燃烧生成Fe2O3
(11分)离子反应是中学化学中重要的反应类型。回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在________。
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系。如分解反应和氧化还原反应可表示为下图。请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系。

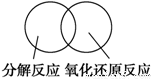
(3)离子方程式是中学生应熟练掌握的化学用语,请写出下列反应的离子方程式:
向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,反应的离子方程式___________________________。在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为_______________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com