
题目列表(包括答案和解析)

| 时间 \CO转化率 \温度 |
1小时 | 2小时 | 3小时 | 4小时 |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a1 | a2 |
A、 表示Zn-Cu原电池反应过程中的电流强度的变化,t时可能加入了双氧水 | B、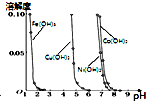 由图可知,可以通过调节溶液pH的方法除去CoCl2溶液中的Fe3+、Cu2+、Ni2+ | C、 表示常温下稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则相同浓度下溶液的pH:NaA<NaB | D、 表示可逆反应2SO2(g)+O2(g)?2SO3(g),△H<0,在t1时刻加热,t2时刻达到新平衡,速率随时间变化的曲线图 |
应用化学反应需要研究化学反应的条件、限度和速率。
(1)773 K、固定体积的容器中,反应CO(g)+2H2(g)CH3OH(g)过程中
能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入amol CO、2amolH2,平衡时能生成0.1a molCH3OH,反应就具工业应用价值。
① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为 ;
② ②在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可) 、 ;
③ ③下列与催化剂有关的说法中,正确的是 (填字母序号)。
④ a.使用催化剂,使反应 CO(g)+2H2(g)CH3OH(g) ΔH>-91kJ·mol-1
⑤ b.使用催化剂,能够提高反应物转化率
c.使用催化剂,不能改变反应的平衡常数K
(2)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如下图I所示。
①Fe电极作 极(填“阴”或“阳”);
②Ni电极的电极反应式为: 。
(3)欲用下图II装置通过测定气体生成量测算硝酸被还原的速率,当反应物的浓度、 用量及其他影响速率的条件确定之后,可以通过测定
用量及其他影响速率的条件确定之后,可以通过测定
推算反应速率。
运用化学反应原理研究氢、氧、氯、碘等单质及其化合物的反应有重要意义
(1)已知:25℃时KSP(AgCl)=1.6×l0-10 KSP(AgI)=1.5×l0-16
海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在。在25℃下,向0.1L0.002mol·L-l的NaCl溶液中加入0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,产生沉淀的原因是(通过计算回答) ,向反应后的浑浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是 (填序号)。
A.BaO2 + H2SO4= BaSO4 ↓ + H2O2
B.2NH4HSO4 (NH4)2S2O8 + H2↑
(NH4)2S2O8 + H2↑
(NH4)2S2O8 + 2H2O = 2NH4HSO4 + H2O2
C.CH3CHOHCH3 + O2→ CH3COCH3 + H2O2
D.乙基蒽醌法见下图
(3)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示。
注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg·L―1的条件下进行。图1中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+;d:H2O2+Zn2+;e:H2O2+Mn2+;图2中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关)。
由上述信息可知,下列叙述错误的是 (填序号)。
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小
运用化学反应原理研究氢、氧、氯、碘等单质及其化合物的反应有重要意义
(1)已知:25℃时KSP(AgCl)=1.6×l0-10 KSP(AgI)=1.5×l0-16
海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在。在25℃下,向0.1L0.002mol·L-l的NaCl溶液中加入0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,产生沉淀的原因是(通过计算回答) ,向反应后的浑浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是 (填序号)。
A.BaO2 + H2SO4= BaSO4 ↓ + H2O2
B.2NH4HSO4 (NH4)2S2O8 +
H2↑
(NH4)2S2O8 +
H2↑
(NH4)2S2O8 + 2H2O = 2NH4HSO4 + H2O2
C.CH3CHOHCH3 + O2→ CH3COCH3 + H2O2
D.乙基蒽醌法见下图

(3)某文献报导了不同金属离子及其浓度对双氧水氧化降解海藻酸钠溶液反应速率的影响,实验结果如图1、图2所示。

注:以上实验均在温度为20℃、w(H2O2)=0.25%、pH=7.12、海藻酸钠溶液浓度为8mg·L―1的条件下进行。图1中曲线a:H2O2;b:H2O2+Cu2+;c:H2O2+Fe2+;d:H2O2+Zn2+;e:H2O2+Mn2+;图2中曲线f:反应时间为1h;g:反应时间为2h;两图中的纵坐标代表海藻酸钠溶液的粘度(海藻酸钠浓度与溶液粘度正相关)。
由上述信息可知,下列叙述错误的是 (填序号)。
A.锰离子能使该降解反应速率减缓
B.亚铁离子对该降解反应的催化效率比铜离子低
C.海藻酸钠溶液粘度的变化快慢可反映出其降解反应速率的快慢
D.一定条件下,铜离子浓度一定时,反应时间越长,海藻酸钠溶液浓度越小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com