
题目列表(包括答案和解析)

| 滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 16.30 |
| 2 | 20.00 | 0.00 | 16.22 |
用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
① → 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
|
测定次序 |
第一次 |
第二次 |
第三次 |
第四次 |
|
初始读数(mL) |
0.40 |
0.10 |
0.90 |
0.00 |
|
最终读数(mL) |
25.05 |
20.10 |
21.00 |
19.90 |
|
V标(mL) |
24.65 |
20.00 |
20.10 |
19.90 |
III、实验数据处理:略
请回答下列问题:
(1)将步骤I中的操作补充完整:
①__________________________
②__________________________
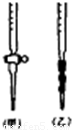
(2)KMnO4(H+)溶液应装入________式滴定管进行滴定;
(3)向锥形瓶中滴加MnSO4溶液的作用是_____________________________________;判断已达滴定终点的现象是:_____________________________________;
(4)该滴定反应的离子方程式为:__________________________________________;
(5)实验测得草酸溶液的浓度为_____________mol/L;
(6)下列操作会引起实验结果偏高的是_____________
A.向锥形瓶中加入了较多 MnSO4溶液
B.滴定振摇时,锥形瓶中溶液溅出
C.滴定时,锥形瓶内壁附有紫红色溶液,未用蒸馏水冲洗
D.滴定结束时,仰视读数
A.用盐酸滴定氢氧化钠时,滴定前,酸式滴定管内无气泡,滴定后产生气泡
B.用盐酸滴定氢氧化钠时,用甲基橙作指示剂,接近滴定终点,溶液由黄色转变为橙色,但不足半分钟又转为黄色,继续滴加盐酸,溶液颜色又转变为橙色,持续半分钟后颜色不变
C.某学生要配制0.1 mol·L-1的稀H2SO4 100 mL,当加蒸馏水到离容量瓶刻度线1—2 cm处时,改用胶头滴管滴加,结果不慎使液面稍稍超过刻度线一点,将多余部分吸出,使凹液面最低点与刻度线相切
D.物质的量浓度为0.05 mol·L-1的NaOH标准溶液因与空气接触吸收了少量CO2,用此标准液滴定未知物质的量浓度的HCl溶液
用浓度为0.10 mol/L的KMnO4(H+)溶液滴定未知浓度的H2C2O4(弱酸)溶液,其实验步骤如下:
I、滴定前的准备:
① → 用蒸馏水清洗 → 用待装溶液润洗 → 装液→ ② → 调节液面在零刻度或零刻度以下 → 记录初始读数
II、滴定:
分别取20.00 mL 草酸溶液于4个洁净的锥形瓶中,滴加几滴MnSO4溶液,然后用标准的KMnO4(H+)溶液进行滴定至终点,记录最终读数。数据如下:
| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 初始读数(mL) | 0.40 | 0.10 | 0.90 | 0.00 |
| 最终读数(mL) | 25.05 | 20.10 | 21.00 | 19.90 |
| V标(mL) | 24.65 | 20.00 | 20.10 | 19.90 |
| 滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 16.30 |
| 2 | 20.00 | 0.00 | 16.22 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com