
题目列表(包括答案和解析)
在一定条件下,反应N 十3H
十3H
 2NH3,在2L密闭容器中进行,5main内氨的质量
2NH3,在2L密闭容器中进行,5main内氨的质量
增加了1.7g,则反应速率为 ( )
A. (H
(H )=0.03mol/(L·min) B.
)=0.03mol/(L·min) B. (N
(N )=0.02mol/(L·min)
)=0.02mol/(L·min)
c. (NH
(NH )=0.17g/(L·mitt) D.
)=0.17g/(L·mitt) D. (NH
(NH )=O.O1mol/(L·min)
)=O.O1mol/(L·min)
(9分)在某温度下,将H2和I2各0.1 mol的气态混合物充入2 L的密闭容器中,充分反应,达到平衡后,测得C(HI)=0.02mol/L。
(1)求该反应的平衡常数;
(2)在上述温度下,陔容器中若通入H2和I2各4.0 mol的气态混合物,求达到化学平衡状态时各物质的浓度。
(正常进度)
(1)写出以30%KOH溶液为电解质溶液,甲烷燃料电池的负极电极反应式______。
(2)在标准状况下,甲烷和氧气的混合气体224mL,充分燃烧后,将生成的气体通入100mL 0.02mol/L的石灰水,得到0.1g白色沉淀。求混合气体中甲烷和氧气的体积比。
(正常进度)
(1)写出以30%KOH溶液为电解质溶液,甲烷燃料电池的负极电极反应式______。
(2)在标准状况下,甲烷和氧气的混合气体224mL,充分燃烧后,将生成的气体通入100mL 0.02mol/L的石灰水,得到0.1g白色沉淀。求混合气体中甲烷和氧气的体积比。
下图中A、B均为固体,其中B为单质。下图可用于工业生产F。回答下列问题:
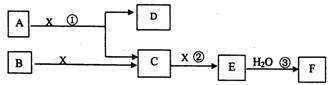
(1)A的化学式为___________________。
(2)反应①是一个氧化还原反应,该反应发生时,每生成4mol气体C,转移电子
_________________mol。
(3)写出D与铝单质反应的化学方程式______________________。
(4)反应②是可逆反应,在2L的密闭容器中投入4molC和3molX,10分钟后反应达到平衡,平衡时混合气体共6mol,则下列说法正确的是___________(填写序号字母)。
A. 工业制取F时,C和X生成E的反应是在吸收塔进行
B. 这10分钟内,X的平均反应速率是0.lmol/(L?min)
C. 当C和X的消耗速率比为2:1时,标志着反应达到平衡
D. 平衡时C的转化率是50%
E. 在工业生产中可以通过增加X浓度来提高C的转化率
F. 工业生产中直接用水来吸收E
(5)写出过量气体C与氢氧化钠溶液反应的化学方程式
_______________________________________________________。
(6)将5mL0.02mol/L的F溶液与5mL0.02mol/LNaOH溶液充分混合,若混合后溶液的体积为10mL,则混合液的pH是___________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com