
题目列表(包括答案和解析)
在四个不同容器中且不同条件下进行N2 + 3H2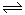 2NH3反应,根据在相同时间内测定的结果判断生成氨的速率最快的是( )
2NH3反应,根据在相同时间内测定的结果判断生成氨的速率最快的是( )
A.V(NH3)=0.5 mol •L-1-•min-1 B.V(H2)=0.02mol •L-1-• s -1
C.V(N2)=0.2 mol •L-1-•min-1 D.V(H2)=0.3 mol •L-1-•min-1
对反应A+B=AB来说,常温下按以下情况进行反应:
①20mL溶液中含A、B各0.01mol ②50mL溶液中含A、B各0.05mol
③0.1 mol•L-1的A、B溶液各10mL ④0.5 mol•L-1的A、B溶液各50mL
四者反应速率大小关系是
A.②>①>④>③ B.④>③>②>① C.①>②>④>③ D.①>②>③>④
下列说法不正确的是( )
A. 不溶于水的物质溶解度为0
B. 绝对不溶解的物质是不存在的
C. 当残留在溶液中的离子浓度小于10-5 mol•L-1时就认为沉淀完全
D. 习惯上将溶解度小于0.01g的电解质称为难溶电解质
现有H2SO4和Na2SO4的混合溶液200mL,其中H2SO4的浓度为1 mol•L-1,Na2SO4的浓度为0.5 mol•L-1。若使该混合溶液中H2SO4和Na2SO4的浓度分别变为2 mol•L-1和0.2 mol·L-1,应加入55.8%的H2SO4溶液(密度为1.35 g/cm3)多少毫升?加水至多少毫升?
在四个不同容器中且不同条件下进行N2 + 3H22NH3反应,根据在相同时间内测定的结果判断生成氨的速率最快的是( )
A.V(NH3)=0.5 mol •L-1-•min-1 B.V(H2)=0.02mol •L-1-•s -1
C.V(N2)=0.2 mol •L-1-•min-1 D.V(H2)=0.3 mol •L-1-•min-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com