
题目列表(包括答案和解析)
 (1)服用含碘化钾的碘药片可抗核辐射.将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题:
(1)服用含碘化钾的碘药片可抗核辐射.将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题:| A、加入少量NaOH固体,钠离子和碳酸根离子浓度均增大 | ||
B、将该溶液加水稀释,
| ||
| C、c(Na+)+c(H+)=c(HCO3- )+c(CO32-)+c(OH-) | ||
| D、c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
已知0.1 mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是
A.加入少量NaOH固体,钠离子和碳酸根离子浓度均增大
B.将该溶液加水稀释, 的比值保持不变
的比值保持不变
C.c(Na+)+c(H+)=c(HCO3- )+c(CO32 -)+c(OH-)
D.c(Na+)=c(HCO3- )+2c(CO32 -)+c(H2CO3)
(14分)(1)服用含碘化钾的碘药片可抗核辐射。将碘片剥去糖衣皮研粹后置于试管中制得无色水溶液,并加入几滴淀粉试液,然后向试管中逐滴加入氯水,观察到溶液由无色变为蓝色,若继续滴加氯水后蓝色溶液又褪为无色,试回答下列问题:
①溶液颜色由无色变蓝色的理由: (用离子反应方程式表示);
②完成并配平溶液颜色由蓝色变为无色的化学反应方程式(如果系数是1,不用填写):
+ + → HIO3 +
(2)观察如下反应,总结规律,然后完成下列问题:
(A) Al(OH)3 + H2O  Al(OH)4- + H+ (B) NH3 + H2O
Al(OH)4- + H+ (B) NH3 + H2O
 NH4+ + OH-
NH4+ + OH-
①已知B(OH)3是一元弱酸,其电离方程式为 ;
②N2H4是二元弱碱,其电离方程式为 。
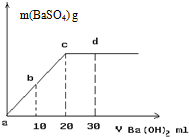
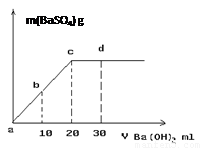
(3)常温下,向1.0mol/L的NaHSO4溶液中逐滴加入等物质的量浓度的Ba(OH)2溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示。a、b、c、d分别表示实验时不同阶段的溶液。其中b点所示溶液呈 (填“酸性”、“中性”、或“碱性”),c点所示的离子方程式为 。
(4)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl-)。则溶液显 性(填“酸性”、“中性”、或“碱性”);用含a的代数式表示NH3·H2O的电离常数Kb= 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com