
题目列表(包括答案和解析)
1996年诺贝尔化学奖授予对发现 ![]() 有重大贡献的三位科学家.
有重大贡献的三位科学家.![]() 分子是形如球状的多面体(如图2—20),该结构的建立基于以下考虑:
分子是形如球状的多面体(如图2—20),该结构的建立基于以下考虑:

①![]() 分子中每个碳原子只跟相邻的3个碳原子形成化学键;②
分子中每个碳原子只跟相邻的3个碳原子形成化学键;②![]() 分子只含有五边形和六边形;③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2.据上所述,可推知
分子只含有五边形和六边形;③多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2.据上所述,可推知![]() 分子有12个五边形和20个六边形,
分子有12个五边形和20个六边形,![]() 分子所含的双键数为30.请回答下列问题:
分子所含的双键数为30.请回答下列问题:
(1)固体![]() 与金刚石相比较,熔点较高者应是___________,理由是_________.
与金刚石相比较,熔点较高者应是___________,理由是_________.
(2)试估计![]() 跟
跟![]() 在一定条件下能否发生反应生成
在一定条件下能否发生反应生成![]()
![]() (填“可能”或“不可能”)________.并简述其理由:_______.
(填“可能”或“不可能”)________.并简述其理由:_______.
(3)通过计算,确定![]() 分子所含单键数为________.
分子所含单键数为________.
(4)![]() 分子也已制得,它的分子结构模型可以与
分子也已制得,它的分子结构模型可以与![]() 同样考虑而推知,通过计算确定
同样考虑而推知,通过计算确定![]() 分子中五边形和六边形的数目.
分子中五边形和六边形的数目.![]() 分子中所含五边形数为__________,六边形数为________.
分子中所含五边形数为__________,六边形数为________.
(5)德国和美国科学家首次制造出了由20个碳原子组成的空心笼状分子,如图2-21所示.这一成果刊登在2000年9月7日出版的英国《自然》杂志上.根据理论计算,包含20个碳原子、仅仅由正五边形构成的![]() 分子是富勒式结构分子中最小的一种.
分子是富勒式结构分子中最小的一种.![]() 中有__________个五边形;共有______条棱边.
中有__________个五边形;共有______条棱边.

(6)目前,科学家拟合成一种“二重构造”的球型分子,即把“足球型”的![]() 与“足球型”的
与“足球型”的![]() 的分子进行重新构造,并使硅原子与碳原子以共价键结合.请回答下列问题:
的分子进行重新构造,并使硅原子与碳原子以共价键结合.请回答下列问题:
①你认为![]() 与
与![]() 的分子应采取怎样的镶嵌_________,理由是________.
的分子应采取怎样的镶嵌_________,理由是________.
②“二重构造”后的晶体属于_________晶体,其熔点与![]() 、
、![]() 相比_______.
相比_______.
(7)最近有人用一种称为“超酸”的化合物![]() 和
和![]() 反应,使
反应,使![]() 获得一个质子,得到一种新型离子化合物
获得一个质子,得到一种新型离子化合物![]() .回答如下问题:
.回答如下问题:
①以上反应类型上可以跟中学化学课本中的一个化学反应相比拟,后者是_______________________.
②上述阴离子![]() 的结构可以跟图2-22的硼二十面体相比拟,也是一个闭合的纳米笼,而且,
的结构可以跟图2-22的硼二十面体相比拟,也是一个闭合的纳米笼,而且,![]() 子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过.请在图2-23中添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子.
子有如下结构特征:它有一根轴穿过笼心,依据这根轴旋转360°/5的度数,不能察觉是否旋转过.请在图2-23中添加原子(用元素符号表示)和短线(表示化学键)画出上述阴离子.


(本题共12分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: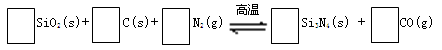
29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是 ,其还原产物是 。
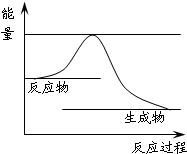
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。
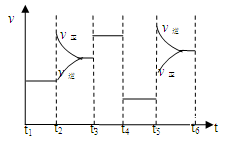
32.该反应的平衡常数表达式为K= 。升高温度,其平衡常数 (选填“增大”、“减小”或“不变”)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆 渐变的原因是
,t3引起变化的因素为 ,t5时引起v逆大变化、v正小变化的原因是 。
(本题共12分)
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:

29.配平反应中各物质的化学计量数,并标明电子转移方向和数目。
30.该反应的氧化剂是 ,其还原产物是 。
31.上述反应进程中能量变化示意图如下,试在图像中用虚线表示在反应中使用催化剂后能量的变化情况。


32.该反应的平衡常数表达式为K= 。升高温度,其平衡常数 (选填“增大”、“减小”或“不变”)。
33.该化学反应速率与反应时间的关系如上图所示,t2时引起v正突变、v逆 渐变的原因是
,t3引起变化的因素为 ,t5时引起v逆大变化、v正小变化的原因是 。


| 1 |
| 2 |
| c(H2) |
| c(CH3OH) |
| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com