
题目列表(包括答案和解析)
(17分)化学反应原理在科研和生产中有广泛应用。
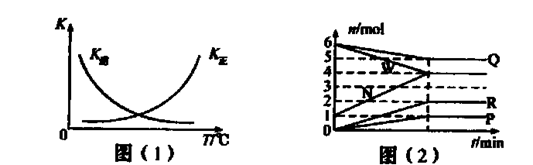
(1)一定条件下,模拟某矿石形成的反应aW+bQ→cN+dP+eR得到两个图像。
①该反应的△H 0(填“>”、“=”或“<”)。
②某温度下,平衡常数表达式为K =c2(X),则由图(2)判定X代表的物质为____。
(2)将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s) 2G(g)。忽略
2G(g)。忽略
固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
则K(915℃)与K(810℃)的关系为K(915℃)____K(810℃)(填“大于”、“等于”或“小于”),a、b、f三者的大小关系为 ,1000℃、3.0 MPa时E的转化率为____。(3)25℃时,H2CO3 HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh= ,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O
HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh= ,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O  HCO3-+OH-的事实 。
HCO3-+OH-的事实 。
 2G(g)。忽略
2G(g)。忽略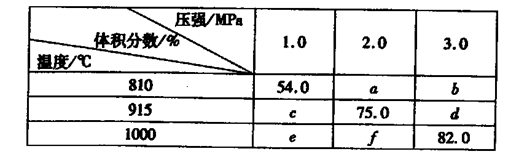
 HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh= ,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O
HCO3-+H+的电离常数Ka=4×10—7 mo1·L-1,则该温度下,NaHCO3的水解常数Kh= ,请用适当的试管实验证明Na2CO3溶液中存在CO32-+H2O  HCO3-+OH-的事实 。
HCO3-+OH-的事实 。 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol 


 2SO3(g) ΔH=-92.3KJ/mol
2SO3(g) ΔH=-92.3KJ/mol 


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com