
题目列表(包括答案和解析)
A、B、C、D、E、F均为短周期主族元素,且原子序数依次增大。短周期元素中C的原子半径最大,B、E同族,E的最外层电子数是电子层数的2倍,A的最高价氧化物水化物为H2AO3,D是地壳中含量最高的金属元素。
(1)A的元素符号是________,C2B2的电子式为________。
(2)B、C、D、F的离子半径由大到小的顺序是________(用离子符号表示)。
(3)E和F相比,非金属性强的是________(用元素符号表示),下列事实能证明这一结论的是________(用符号填空)。
①常温下E的单质呈固态,F的单质呈气态 ②气态氢化物的稳定性:F>E ③E和F形成的化合物中,E显正价 ④F单质能与E的氢化物发生置换反应 ⑤E和F的氧化物的水化物的酸性强弱 ⑥气态氢化物的还原性:E>F
(4)把CDB2溶液蒸干所得的固体物质为________(填化学式)。
(5)C和F可组成化合物甲,用惰性电极电解甲的水溶液,电解的化学方程式为__________________________。
(6)A、B、C三种元素组成的常见化合物乙的溶液中,离子浓度由大到小的顺序为________,pH=10的乙溶液中由水电离产生的c(OH-)=________mol·L-1。
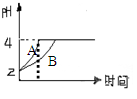
 (2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数
(2)一定温度下的难溶电解质AmBn在水溶液中达到沉淀溶解平衡时,其平衡常数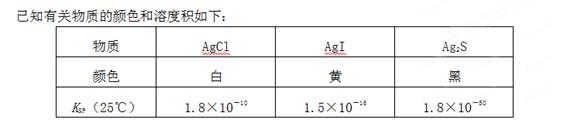


 6CaSiO3+P4O10 10C+P4O10
6CaSiO3+P4O10 10C+P4O10 P4+10CO
P4+10CO C6H6O6+2H++2I- 2
C6H6O6+2H++2I- 2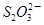 +I2
+I2
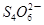 +2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。
+2I-在一定体积的某维生素C溶液中加入a mol·L-1 I2溶液V1mL,充分反应后,用Na2S2O3溶液滴定剩余的I2, 消耗b mol·L-1Na2S2O3溶液V2mL。该溶液中维生素C的物质的量是___________mol。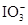 +5
+5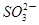 +2H+
+2H+ I2+5
I2+5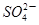 +H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
+H2O生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示: 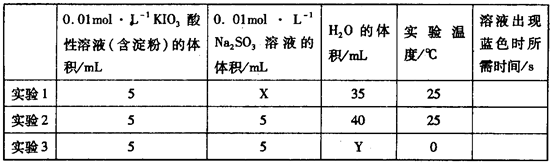
 Ce3++
Ce3++ H2O2+
H2O2+ H2O
H2O
 Ce(OH)4↓+
Ce(OH)4↓+ ______________
______________湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com