(2009?海淀区一模)X、Y、Z、W均为含有10电子的微粒,W为离子,X、Y、Z为分子,且X与Z分子中含有的共用电子数之比为3:4.

(1)X的电子式
;若实验室用如图所示装置制取X,则制取X的化学反应方程式为
Ca(OH)
2+2NH
4Cl
CaCl
2+2NH
3↑+2H
2O
Ca(OH)
2+2NH
4Cl
CaCl
2+2NH
3↑+2H
2O
.
(2)已知:W+X+H
2O→白色沉淀,为进一步确定W,进行如下实验,请补全实验操作、现象和结论:取上述白色沉淀少量置于试管中,
加入氢氧化钠溶液(或足量氢氧化钠溶液),若观察到白色沉淀溶解(或白色沉淀全部溶解),则证明W为Al3+;若观察到白色沉淀不溶解,则证明W为Mg2+
加入氢氧化钠溶液(或足量氢氧化钠溶液),若观察到白色沉淀溶解(或白色沉淀全部溶解),则证明W为Al3+;若观察到白色沉淀不溶解,则证明W为Mg2+
.
(3)常温下,取10ml pH=a的Y的稀溶液,加水稀释时pH随溶液体积的变化如图所示,则Y的化学式为
HF
HF
,下列叙述正确的是
①
①

①Y溶于水部分电离
②稀释后所有离子的浓度均减小
③Y的水溶液通常保存在玻璃瓶中
④稀释后,阴离子的物质的量浓度之和增大
(4)已知H
2的燃烧热为285.8kJ/mol.现有Z和H
2 的混合气体共0.2mol,与O
2完全燃烧生成H
2O(l)和CO
2(g),转移电子的物质的量为1.0mol,放出的热量为117.6kJ.写出Z完全燃烧的热化学反应方程式
CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-890.2kJ/mol
CH4(g)+2O2(g)=CO2(g)+2H2O(1)△H=-890.2kJ/mol
.写出Z和O
2在KOH溶液中构成燃料电池的负极的电极反应式
CH4-8e-+10OH-=CO32-+7H2O
CH4-8e-+10OH-=CO32-+7H2O
.

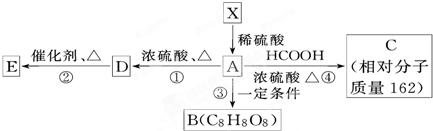
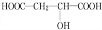 +HCOOH
+HCOOH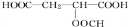 +H2O
+H2O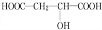 +HCOOH
+HCOOH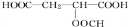 +H2O
+H2O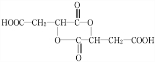

 2NH3(g)△H=-92.2kJ/mol
2NH3(g)△H=-92.2kJ/mol 2NH3(g)△H=-92.2kJ/mol
2NH3(g)△H=-92.2kJ/mol


