
题目列表(包括答案和解析)
(12分)下列三个反应在某密闭容器中进行:
反应① Fe(s)+CO2(g) FeO(s)+CO(g) △H1=" a" kJ·mol-1
FeO(s)+CO(g) △H1=" a" kJ·mol-1
反应② 2CO(g)+O2(g) 2CO2(g) △H2=" b" kJ·mol-1
2CO2(g) △H2=" b" kJ·mol-1
反应③ 2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1)则△H3= (用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有 (填序号)。
| A.缩小反应器体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
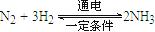 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。(12分)下列三个反应在某密闭容器中进行:
反应①
Fe(s)+CO2(g) FeO(s)+CO(g) △H1="
a" kJ·mol-1
FeO(s)+CO(g) △H1="
a" kJ·mol-1
反应②
2CO(g)+O2(g) 2CO2(g) △H2=" b"
kJ·mol-1
2CO2(g) △H2=" b"
kJ·mol-1
反应③
2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1)则△H3= (用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.再通入CO2
C.升高温度 D.使用合适的催化剂
(4)最近一些科学家研究采用高质子导电性的SCY陶瓷(能传递H+)实现氮的固定——氨的电解法合成,大大提高了氮气和氢气的转化率。总反应式为: 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
 FeO(s)+CO(g) △H1=" a" kJ·mol-1
FeO(s)+CO(g) △H1=" a" kJ·mol-1 2CO2(g) △H2=" b" kJ·mol-1
2CO2(g) △H2=" b" kJ·mol-1 2FeO(s) △H3
2FeO(s) △H3| A.缩小反应器体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
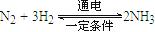 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。(8分)已知反应:CO(g) + H2O(g)H2(g) + CO2(g) ΔH= Q kJ·mol-1,其平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述可逆反应中Q 0(填“大于”或“小于”)。
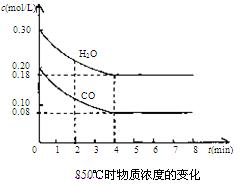
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图。试回答:
①0~4 min的平均反应速率v(CO)=______ mol/(L·min)
②下列表述能作为该可逆反应达到平衡标志的是__________(填序号)。
A.当混合气体的密度保持不变时
B.当反应消耗0.1molCO(g)同时也生成0.1molH2O(g)时
C.当CO(g)的质量分数保持不变时
D.当该反应的ΔH不变时
(3)若要加快该反应速率,同时还要提高CO的转化率,可采取的措施为_____(填序号)。
A.增加水蒸气的量 B.降低温度
C.使用催化剂 D.增大压强 E.不断移走CO2
(8分)已知反应:CO(g) + H2O(g) H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
H2(g) + CO2(g) ΔH=" Q" kJ·mol-1,其平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.9 4 4 | 9 | 1 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com