
题目列表(包括答案和解析)
某实验人员做了下列实验:将一定量1.00mol/L CuSO4溶液和2.00mol/LNaOH溶液混合,得到一种浅绿色沉淀X。将0.454g X隔绝空气在1000℃以上强热,得到一种红色固体Y,质量为0.288g。Y溶于稀硫酸得到另一种红色固体0.128g(已知铜的化合价有+1和+2价)。
(1)该实验人员认为沉淀X可能含有SO42-。请设计一个简单实验确定这一判断。
(2)Y与稀硫酸反应的离子方程式为: 。
(3)通过计算确定X的组成?
(4)混合时CuSO4和NaOH溶液的体积比为 ;写出X→Y的反应方程式::
。
某实验人员做了下列实验:将一定量1.00mol/L CuSO4溶液和2.00mol/LNaOH溶液混合,得到一种浅绿色沉淀X。将4.54g X隔绝空气在1000℃以上强热,得到一种红色固体Cu2O,质量为2.88g。经分析发现X中含SO42—。试通过计算确定X的化学式。
将一定量的SO2和含0.7mol的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应:2SO2
(g) + O2(g) 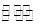 2SO3 (g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少5.6 L(以上气体体积均为标况下)。(计算结果保留一位小数)
2SO3 (g)(正反应放热)。反应达到平衡后,将容器中的混合气体通过NaOH溶液,气体体积减少了21.28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少5.6 L(以上气体体积均为标况下)。(计算结果保留一位小数)
(1)判断该反应达到平衡状态的标志是______________。
A.SO2和SO3浓度相等
B.SO2的百分含量保持不变
C.SO3的生成速率与SO2的消耗速率相等
D.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是_____________。
A. 向装置内再充入N2 B. 向装置内再充入O2
C. 改变反应的催化剂 D. 升高温度
(3)求该反应达到平衡时SO2的转化率
(4)若将平衡混合气体的5 %通入过量的BaCl2溶液,生成沉淀多少克?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com