
题目列表(包括答案和解析)
 某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验:
某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4?yCu(OH)2].为了加以验证,小组成员进行了如下实验:MnO2是一种重要的催化剂。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2实验,其流程如下: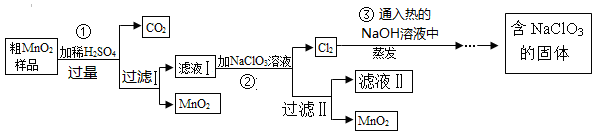
(1)写出1个用二氧化锰作催化剂的化学反应方程式 。
(2)第②步反应的离子反应方程式为 。
(3)检验过滤Ⅰ所得的MnO2是否洗涤干净的方法是 。
(4)第③步反应的化学反应方程式为 。
(5)上述流程中可用于循环使用的物质是 (填化学式);过滤操作和蒸发操作中都要用到的玻璃仪器是 。
(6)若粗MnO2样品的质量为25.38g,第①步反应后,经过滤得到17.4g MnO2,并收集到0.448LCO2(标准状况下),则样品中所含的MnO质量为 g。
常温下甲醛是一种无色、有特殊刺激性气味的气体,易溶于水,是世界卫生组织(WHO)确定的致癌物和致畸形物之一。我国规定:居室空气中甲醛的最高容许浓度为0.08 mg/m3。
某研究性学习小组设计用如下方法测定某居室空气中甲醛的含量(假设空气中无其他还原性气体):
(1)测定原理:KMnO4(H+)溶液为强氧化剂,可氧化甲醛和草酸。
反应的离子方程式为:![]()
![]()
(2)测定装置:部分装置如右图所示(a、b为止水夹)。

(3)实验步骤:
①检查装置气密性(气密性良好)。
②用__________(填仪器名称)准确移取25.00 mL 1.00×10-3 mol·L-1 的高锰酸钾溶液(过量)于广口瓶中并滴入3滴6 mol·L-1 H2SO4溶液备用。
③将2.00×10-3 mol·L-1的草酸标准溶液置于__________(填仪器名称)中备用。
④打开a,关闭b,用注射器抽取100 mL新装修的室内空气。关闭a,打开b,再缓缓推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再如此重复4次(共5次)。如果压送气体时速度过快,可能会产生什么不利后果?______________________________。
⑤将广口瓶中的溶液转入锥形瓶中(润洗广口瓶2~3次,并将洗涤液全部转入锥形瓶)。如果没有润洗,所测甲醛的含量将__________(填“偏高”“偏低”或“无影响”)。
⑥用草酸标准溶液滴定锥形瓶中的溶液,并记录滴定所消耗的草酸溶液体积。
本实验是否需要指示剂?(如果需要,请写出指示剂的名称;如果不需要,试说明终点时的实验现象)______________________________。
⑦再重复实验两次。
(4)数据处理:分别于装修完工后的第1天、第7天、第30天(室内始终保持通风换气状况)对室内空气进行取样,通过实验测得以下三组数据(每次实验所取的KMnO4溶液均为25.00 mL):
| 装置后 第n天 | 草酸溶液/mL | 甲醛的浓度mg/m3 | |||
| 1 | 2 | 3 | 平均值 | ||
| 1 | 15.86 | 15.72 | 15.67 | 15.75 | |
| 7 | 26.17 | 26.36 | 26.38 | 26.30 | |
| 30 | 30.90 | 30.67 | 30.81 | 30.79 | |
设KMnO4溶液的物质的量浓度为c1 mol·L-1,KMnO4溶液的体积为V1 mL;草酸溶液的物质的量浓度为c2 mol·L-1,草酸溶液的平均体积为V2 mL。
则:室内空气中甲醛浓度(mg/m3)的代数式为__________,第30天室内空气中甲醛浓度为__________(精确到小数点后两位),并判断此时主人__________(填“能”或“不能”)入住。
(10分)某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中 除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验:
除Cu(OH)2外还有碱式硫酸铜【可表示为xCuSO4.yCu(OH)2】.为了加以验证,小组成员进行了如下实验:
①分别配置50mL物质的量浓度均为0.100mol/L的CuSO4溶液和NaOH溶液;
②准确量取10mL CuSO4溶液倒入50ml烧杯中
③向烧杯中匀速加入0.100 mol/L的NaOH溶液,并每加入1.00mlNaOH溶液用pH计测一次混合溶液的pH
④当滴入NaOH溶液的体积达到30ml时停止实验,并绘制出向CuSO4溶液中滴加NaOH溶液时PH变化曲线。如右图
请回答下列问题:
(1)配置溶液时需要使用烧杯、 、 等玻璃仪器;下列仪器中可用于向烧杯中加入NaOH溶液的仪器是
| A.胶头滴管 | B.酸式滴定管 | C.碱式滴定管 | D.量筒 |
(12分)某研究性学习小组通过查阅资料发现,CuSO4溶液与NaOH溶液反应生成的沉淀中除Cu(OH)2外,还有碱式硫酸铜[化学式可表示为xCuSO4·yCu(OH)2]。为了加以验证,小组成员进行了如下实验:
①分别配制50mL物质的量浓度均为0.L00mol.L-1CuSO4溶液和NaOH溶液;
②准确量取l0mLCuSO4溶液倒入50mL烧杯中;
③向烧杯中匀速加入0.l00mol.L—NaOH溶液,并每加入1.00mLNaOH溶液用pH计测一次混合溶液的pH;
④当滴人NaOH溶液的体积达到30mL时停止实验,并绘制出向CuSO4溶液中滴加NaOH溶液时pH变化曲线。
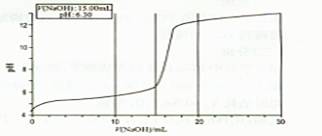
请回答以下问题:
(1)V(NaOH)在0.00mL~2.00mL之间时,溶液中无沉淀产生,但pH变化较快的原因是 ;
(2)V(NaOH)在2.00mL~ 15.00mL之间时,溶液中产生绿色沉淀,并不断增加,
经检测此沉淀为碱式硫酸铜。已知蒸馏水的pH为6.32,当V(NaOH)为15.00mL时,溶液pH为6.30,则可求得x= ,y= ;
(3)V(NaOH)在17.00mL~20.00mL之间时,溶液中出现蓝色沉淀,并不断增
加。已知V(NaOH)为20.00mL时,溶液pH为12.25,则此时沉淀中 (填
“含”或“不含”)有碱式硫酸铜,理由是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com