
题目列表(包括答案和解析)
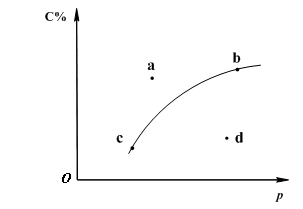
对于可逆反应2A(?)+B(g)![]() 2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
2C(g);下图是其它条件一定时反应中C的百分含量与压强的关系曲线。回答下列问题:
(1)物质A的状态是 (填“气体”、“液体”或“固体”);
(2)图-1中a、b、c、d四点中表示未达到平衡状态且v正<v逆 的点是 ;
(3)在a、b、c三种条件下达平衡时,v(a)、v(b)、v(c)按由大到小排序___________;
 |
|
(4)对于2SO2(g)+O2(g)![]() 2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
2SO3(g);ΔH=-198 kJ/mol。在实际生产过程中,原料气中SO2为7%(体积分数)、O2为11%,常压下进行,控制温度在450℃左右。
请问原料气中SO2与O2的体积比不是2∶1,而要7∶11(大约2∶3)的原因是
;如果在恒容容器中,仅把另外82%的其他气体“抽出来”,是否会减小SO2的转化率 (填“会”或“不会”)。
一定温度时,A(g)与B(g)反应可生成C(g)。反应过程中A、B、C浓度的变化情况如图I所示。若保持其它条件不变,温度分别为T1℃和T2℃时,B的体积分数与时间的关系如图Ⅱ所示。则下列结论不正确的是
 |
A.该平衡体系的化学方程式为:A(g)+3B(g)![]() 2C(g)
2C(g)
B.(t1+10)min时,保持容积总压强不变,通入稀有气体,平衡向逆反应方向移动
C.在t1时间内使用B表示该反应的平均速率为3/5 t1mol/(L·min)
D.其它条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
 |
 2C(g)
2C(g)
(1)若甲是中学化学中常见的红棕色粉末状固体,则单质A与NaOH溶液反应的离子方程式为_______________;A与甲反应在工业上一个重要用途是_______________。
(2)若乙的水溶液呈弱酸性,丙是一种大气污染物,有刺激性气味。试写出乙在水溶液中发生电离时的电离方程式:_______________;丙与乙反应的化学方程式:_______________。

(3)若乙的水溶液呈弱碱性,并可用作农业化肥,D通常状况下为气体,则进行下列研究:现将0.40 mol C和0.20 mol D充入
①若t1=10 min,则0至t1时间内C物质的平均反应速率为_______________;该反应在t2时达到平衡,其化学反应方程式为_______________。
②根据图中曲线变化情况判断,t1时刻改变的反应条件可能是_______________。
a.加入了催化剂
b.降低了反应的温度
c.向容器中又充入了气体D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com