
题目列表(包括答案和解析)
一定温度下,向体积不变的密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时,测得NH3的物质的量为0.6mol。若该容器中开始时N2的物质的量为2.0mol,H2为6.0mol,则平衡时NH3的物质的量为( )
A.n(NH3)=1.2mol
B.n(NH3)<1.2mol
C.n(NH3)>1.2mol
D.无法确定
一定温度下,向体积不变的密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时,测得NH3的物质的量为0.6mol。若该容器中开始时N2的物质的量为2.0mol,H2为6.0mol,则平衡时NH3的物质的量为( )
A.n(NH3)=1.2mol
B.n(NH3)<1.2mol
C.n(NH3)>1.2mol
D.无法确定
在密闭容器中进行反应①Fe(s)+C02(g) ![]() FeO(s)+CO(g) ΔH1=akJ·mol一
FeO(s)+CO(g) ΔH1=akJ·mol一
反应②2CO(g)+02(g) ![]() 2C02(g) △H2=b kJ·mol-
2C02(g) △H2=b kJ·mol-
反应③2Fe(s)+02(g) ![]() 2FeO(s)△H3
2FeO(s)△H3
(1) △H3= (用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K= ,已知500℃时反应①的平衡常数K=1.0,在此温度下2 L密闭容器中进行反应①,Fe和C02的起始量均为2.0 mol,达到平衡时CO2的转化率为 ,CO的平衡浓度为 。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是C02浓度的两倍,则
a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有 (填序号)。
A.缩小反应器体积 B.再通入CO2 c.升高温度 D.使用合适的催化剂
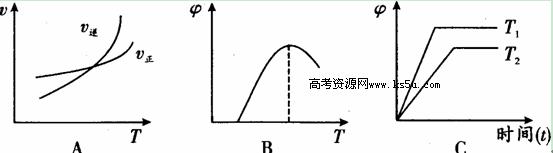
(4)下列图像符合反应①的是 (填序号)(图中V是速率、φ为混合物中CO含量,T为温度)。
氮是地球上含量丰富的一种元素,氮及其化合拖把在工农业生产、生活中有着重要作用。请回答:
(1)右图是1molNO2和1molCO反应生成
和NO过程中能量变化示意图,请写出
NO2和CO反应的热化学方程式 。
(2)在一定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) ![]() 2NH3(g),其化学
2NH3(g),其化学
平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | … |
K/(mol?L-1)2 | 4.1×106 | K1 | K2 | … |
完成下列问题:
①比较K1、K2的大小;K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保护不变
(3)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出墁酸肼第一步水解反应的离子方程式 。
②盐酸肼水溶液中离子浓度的排列顺序正确的是 (填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5?H2O+])> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5?H2O+])+c(H+)= c(H+)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)>
甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整。向反应系统同时通入甲烷、氧气和水蒸气,发生的主要化学反应有:
| 反应过程 | 化学方程式 | 焓变△H(kJ/mol) | 活化能Ea(kJ/mol) |
| 甲烷氧化 | CH4(g)+2O2(g)=CO2(g)+2H2O(g) | -802.6 | 125.6 |
| CH4(g)+O2(g)=CO2(g)+2H2(g) | -322.0 | 172.5 | |
| 蒸汽重整 | CH4(g)+H2O(g)=CO(g)+3H2(g) | 206.2 | 240.1 |
| CH4(g)+2H2O(g)=CO2(g)+4H2(g) | 165.0 | 243.9 |
回答下列问题:
(1)反应CO(g)+H2O(g)=CO2(g)+H2(g)的△H= kJ/mol。
(2)在初始阶段,甲烷蒸汽重整的反应速率 甲烷氧化的反应速率(填大于、小于或等于)。
(3)对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可表示平衡常数(记作KP),则反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的KP= ;
CO(g)+3H2(g)的KP= ;
随着温度的升高,该平衡常数 (填“增大”、“减小”或“不变”)。
(4)从能量角度分析,甲烷自热重整方法的先进之处在于 。
(5)在某一给定进料比的情况下,温度、压强对H2和CO物质的量分数的影响如下图:

①若要达到H2物质的量分数>65%、CO的物质的量分数<10%,以下条件中最合适的是 。
A.600℃,0.9Mpa B.700℃,0.9MPa C.800℃,1.5Mpa D.1000℃,1.5MPa
②画出600℃,0.1Mpa条件下,系统中H2物质的量分数随反应时间(从常温进料开始计时)
的变化趋势示意图:

(6)如果进料中氧气量过大,最终导致H2物质的量分数降低,原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com