
题目列表(包括答案和解析)
(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是________(填序号);配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。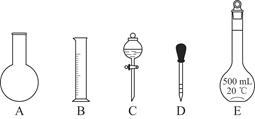
②下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为________g。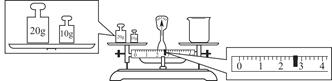
④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_____________________________________________。
(1)下列实验操作或对实验事实的描述不正确的是________(填序号)。
A.不宜用瓷坩埚灼烧氢氧化钠或碳酸钠
B.使用容量瓶配制溶液时,俯视刻度线定容后所得溶液浓度偏大
C.分液操作时,由于分液漏斗下端已沾满下层液体,故上层液体要从上口倒出
D.用托盘天平称量11.74 g氯化钠晶体
E.用结晶法分离硝酸钾和氯化钠的混合物
(2)实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
①如图所示的仪器中配制溶液肯定不需要的是________(填序号);配制上述溶液还需用到的玻璃仪器是________(填仪器名称)。
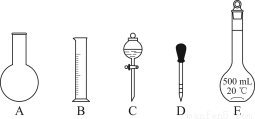
②下列操作中,容量瓶所不具备的功能有________(填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
③请计算需用托盘天平称取固体NaOH的质量为________g。某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,烧杯的实际质量为________g。
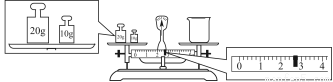
④根据计算得知,所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为________mL(计算结果保留一位小数)。配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是_____________________________________________。
 溶液450 mL和0.5
溶液450 mL和0.5  硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:
硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题: 



(1)下列实验操作或对实验事实的描述不正确的是________(填序号,错选一个倒扣2分,不出现负分)
①用量筒量得稀硫酸溶液8.0mL;②浓硫酸不小心沾在皮肤上,应立即用大量的水冲洗;③用热的浓HCl洗涤附着有MnO2的试管;④在硫酸铜晶体结晶水含量的测定中,若加热后的无水硫酸铜粉末表面发黑,则所测结晶水含量可能会偏高;⑤Fe(OH)3胶体与FeCl3溶液可用过滤的方法分离;⑥用碱式滴定管量得KMnO4溶液20.50mL;⑦实验室快速制备少量H2、O2、NH3、HCl可以用同一种气体发生装置;⑧配制一定浓度的溶液时,若定容时不小心加水超过容量瓶的刻度线,应立即用滴管吸去多余的部分。
(2)有常用玻璃仪器组成的下列六种实验装置(根据需要可在其中加入液体或固体)

①能用做干燥二氧化硫气体的装置有________;(填代号,下同)
②既能用于收集氯气又能用于收集一氧化氮气体的装置有________;
③在氯气和铁反应实验中,能添加在制气和化合反应装置之间以除去氯气中氯化氢等杂质气体的装置有________;
若用C装置做二氧化硫与烧杯中氢氧化钠溶液反应实验,则其中广口瓶的作用是________。
(3)学校化学兴趣小组知道二氧化锰能作过氧化氢分解的催化剂后,想再探究其他一些物质如氧化铝是否也可以作过氧化氢分解的催化剂。请你一起参与他们的探究过程。
①[问题]:Al2O3能不能作过氧化氢分解的催化剂呢?
②[猜想]:Al2O3能作过氧化氢分解的催化剂。
③[实验验证]:

④[结论]:Al2O3能加快过氧化氢分解速率,故Al2O3能作过氧化氢分解的催化剂。
⑤[讨论与反思]:经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢的催化剂,还要补充一个探究实验:
实验三:[实验目的]:探究________。
[实验步骤]:①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束后,将实验二试管里的物质进行过滤、洗涤、________、称量;④对比反应前后Al2O3的质量。
[讨论]:如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂。
但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验:探究________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com