
题目列表(包括答案和解析)
某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)滴定开始后,眼睛注视_________________________________________________.
直到加入一滴氢氧化钠后,溶液由__________变为___________时为止.
(5)下列操作中可能使所测盐酸的浓度数值偏低的是________.
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
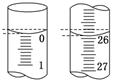
(6)若滴定开始和结束时,碱式滴定管中的液面如图所示,则起始读数为________mL,终点读数为_______________________ mL;所用盐酸溶液的体积为____________mL.
某学生用0.1mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)滴定开始后,眼睛注视_________________________________________________.
直到加入一滴氢氧化钠后,溶液由__________变为___________时为止.
(5)下列操作中可能使所测盐酸的浓度数值偏低的是________.
A.碱式滴定管未用标准溶液润洗就直接注入标准液
B.滴定前盛放盐酸的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管在滴定前有气泡,滴定后气泡消失
D.读取氢氧化钠溶液体积时,开始仰视读数,滴定结束时俯视读数
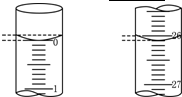
(6)若滴定开始和结束时,碱式滴定管中的液面如图所示,则起始读数为________mL,终点读数为_______________________ mL;所用盐酸溶液的体积为____________mL.
 某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生用已知物质的量浓度的盐酸来滴定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定 次数 |
待测氢氧化钠溶液的体积/mL | 0.1000 mol/L盐酸的体积(mL) | |
| 滴定前刻度 | 定后刻度 | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
 某学生在实验室测定一未知浓度的稀盐酸,已知在25ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
某学生在实验室测定一未知浓度的稀盐酸,已知在25ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
(12分)某学生在实验室测定一未知浓度的稀盐酸,已知在25ml氢氧化钠标准溶液中逐滴加入0.2mol/L醋酸溶液的PH变化曲线如图所示:
(1)该氢氧化钠溶液的物质的量浓度为 mol.L—1
(2)在B点,a 12.5ml(填“>”、“<”或“=” )。
(3)配制100 mL NaOH标准溶液所需仪器除托盘天平、玻璃棒、胶头滴管外,还需要
(4)用 量取20.00 mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用NaOH标准溶液进行滴定。为了减小实验误差,该同学一共进行了三次实验,假设每次所取稀盐酸体积均为20.00 mL,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 19.00 | 23.00 | 23.02 |
该盐酸的浓度约为___________________(保留两位有效数字)。
滴定达到终点的标志是
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com