
题目列表(包括答案和解析)
(13分)A、B、C、D、E是元素周期表中前四周期常见元素,其原子序数依次增大。已知:
|
A |
单质在自然界中硬度最大 |
|
B |
原子中s能级与p能级电子数相等且有单电子 |
|
C |
C同在B的下一周期,C的电离能数据(kJ ·mol-1)为:I1=738 I2=1451 I3=7732 I4=10540 |
|
D |
单质密度小,较好的延展性,广泛用于食品包装,D的氧化物是两性氧化物 |
|
E |
单质是一种常见金属,与O元素能形成黑色和砖红色两种氧化物 |
(1)写出A元素基态原子的价电子排布图 。当C单质、D单质和NaOH溶液形成原电池时,该原电池的负极的电极反应式为:
(2)常温下,某气态单质甲分子与AB分子核外电子数相等,则一个甲分子中包含 个π键,在A—H、B—H两种共价键中,键的极性较强的是 (用元素符号表示)。D元素原子核内中子数比质子数多1,则D原子可以表示为 ,其原子核外有 种运动状态不同的电子。
(3)B的氢化物的熔沸点比与它同主族的下一周期元素的氢化物的熔沸点高,原因是
。
(4)通常情况下,A的燃烧热为a kJ ·mol-1,C的燃烧热为b kJ ·mol-1,则C与AO2反应生成A的热化学方程式为 。
常温下某气烃与![]() 混合,在密闭容器里点火完全燃烧,又恢复至常温,容器内气体压强为反应前的一半,经
混合,在密闭容器里点火完全燃烧,又恢复至常温,容器内气体压强为反应前的一半,经![]() 溶液吸收容器内几乎真空,则此气态烃的分子式可能是
溶液吸收容器内几乎真空,则此气态烃的分子式可能是
[ ]
|
A. |
B. |
|
C. |
D. |
常温下某气烃与![]() 混合,在密闭容器里点火完全燃烧,又恢复至常温,容器内气体压强为反应前的一半,经
混合,在密闭容器里点火完全燃烧,又恢复至常温,容器内气体压强为反应前的一半,经![]() 溶液吸收容器内几乎真空,则此气态烃的分子式可能是
溶液吸收容器内几乎真空,则此气态烃的分子式可能是
[ ]
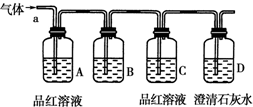 某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分.该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想.
某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分.该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想.湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com