
题目列表(包括答案和解析)
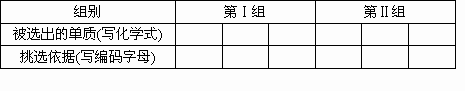
今有下列两组单质,试将每组单质从三个不同角度进行“分类”.每种“分类”都可分别挑选出一种单质,它跟其他三种单质属于不同的“类”.将挑选出的单质(写化学符号)和挑选依据(写编码)列在下面相应的表格内.
两组单质为:(Ⅰ)O2,F2,S,N2;(Ⅱ)Fe,Na,Al,Si.
“挑选依据”仅限于以下六种:被挑选出的单质跟其他三种单质不同,是由于:(A)其组成元素不属于金属(或非金属);(B)其组成元素不属于周期表中的同一族;(C)其组成元素不属于周期表中的同一周期;(D)其组成元素不属于主族(或副族)元素;(E)在常温、常压下呈不同物态;(F)在常温下遇水能(或不能)放出气体.
|
铝硅合金(含Si 3.5%)在凝固时收缩率很小,因而这种合金适合于铸造.在下列三种晶体:①铝;②硅;③铝硅合金中,它们的熔点从低到高的顺序是 | |
| [ ] | |
A. |
①③② |
B. |
②①③ |
C. |
③②① |
D. |
③①② |
.下列说法正确的是:
A.在化合物SiC中,Si显正价、C显负价是因为C的电负性大于Si的电负性
B.由于H与F的电负性差值为1.9大于1.7,所以HF是离子化合物
C.基态C原子有两个未成对电子,所以最多只能形成2个共价键
D.所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性
| A.在化合物SiC中,Si显正价、C显负价是因为C的电负性大于Si的电负性 |
| B.由于H与F的电负性差值为1.9大于1.7,所以HF是离子化合物 |
| C.基态C原子有两个未成对电子,所以最多只能形成2个共价键 |
| D.所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性 |
.下列说法正确的是:
A.在化合物SiC中,Si显正价、C显负价是因为C的电负性大于Si的电负性
B.由于H与F的电负性差值为1.9大于1.7,所以HF是离子化合物
C.基态C原子有两个未成对电子,所以最多只能形成2个共价键
D.所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方向性
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com