
(2011?福建模拟)一定条件下铁可以和CO
2发生反应:
Fe(s)+CO
2(g)

FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO
2气体,反应过程中CO
2气体和CO气体的浓度与时间的关系如图所示,求8分钟内CO的平均反应速率v(CO)=
0.075mol?L-1?min-1
0.075mol?L-1?min-1
.
(2)下列措施中能使平衡时c(CO)/c(CO
2)增大的是
A
A
(填序号).
A.升高温度 B.增大压强 C.充入一定量氮气 D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入一定量的CO
2,则CO
2的转化率将
不变
不变
(填“增大”、“减小”、“不变”)
(4)铁的重要化合物在生产生活中应用十分广泛.
①FeSO
4溶液与稍过量的NH
4HCO
3溶液混合,可得含FeCO
3的浊液.若FeCO
3浊液长时间暴露在空气中,固体表面会变为红褐色,写出由FeCO
3生成红褐色物质的反应的化学方程式:
4FeCO3+O2+6H2O═4Fe(OH)3+4CO2
4FeCO3+O2+6H2O═4Fe(OH)3+4CO2
.
②高铁酸钠(Na
2FeO
4)是一种新型饮用水消毒剂.高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)
3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为
2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O
.
(5)已知:2CO(g)+O
2(g)═2CO
2(g)△H=-566kJ/mol;2H
2(g)+O
2(g)═2H
2O(g)△H=-483.6kJ/mol.写出CO和H
2O(g)作用生成CO
2和H
2的热化学方程式
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol
CO(g)+H2O(g)═CO2(g)+H2(g)△H=-41.2kJ/mol
.

 (2011?福建模拟)一定条件下铁可以和CO2发生反应:
(2011?福建模拟)一定条件下铁可以和CO2发生反应: FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0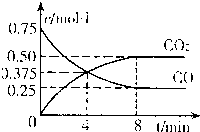 (2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,
(2010?潍坊一模)铁元素及其化合物与人类的生产生活息息相关,