
题目列表(包括答案和解析)
(10分)可逆反应aA(g) + bB(g) cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。
cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。
试比较下列大小关系:T1 T2, P1 P2, ΔH 0,ΔS 0。 使用催化剂的是 反应线。
 cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。
cC(g) + dD(g) ,反应时间与C%(产物C的体积分数)函数关系如图所示。A图表示的是温度不同的曲线,B图表示压强不同的曲线,C图表示使用催化剂和不使用催化剂时的反应曲线。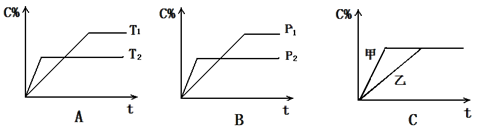
可逆反应:aA(g)+bB(g) cC(g)+dD(g);ΔH=Q,试根据图回答:
cC(g)+dD(g);ΔH=Q,试根据图回答:
(1)压强p1比p2________(填“大”、“小”)。
(2)(a+b)比(c+d)________(填“大”、“小”)。
(3)温度t1℃比t2℃________(填“高”、“低”)。
(4)Q值是________(填“正”、“负”)。
 cC(g)+dD(g);ΔH=Q,试根据图回答:
cC(g)+dD(g);ΔH=Q,试根据图回答:
| c2(CO) |
| c(CO2) |
| c2(CO) |
| c(CO2) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com