
题目列表(包括答案和解析)
(13分)在所给反应条件下,有下列转化关系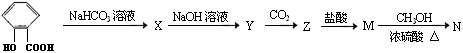
(1)推断下列各步反应所得有机物的结构简式:(每空1分,共5分)
X ;Y ;Z ;M ; N ;
(2)写出下列反应的方程式(每个方程式2分,共8分)
① X → Y
② Y → Z
③ Z → M
④ M → N
(共8分)
在2 L恒容密闭容器中,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(13分)在所给反应条件下,有下列转化关系
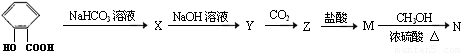
(1)推断下列各步反应所得有机物的结构简式:(每空1分,共5分)
X ;Y ;Z ;M ; N ;
(2)写出下列反应的方程式(每个方程式2分,共8分)
① X → Y
② Y → Z
③ Z → M
④ M → N
(共8分)下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| | IA | | | | | | | 0 |
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | | ⑦ | | ⑧ | |
 组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。
组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) 。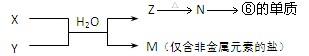
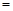 。
。(共16分)
(1)现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
①该反应的逆反应为______反应(填“吸热”或“放热”),且m+n______ p (填“>”、“=”或“<”)。
②减压使容器体积增大时,A的质量分数________。(填“增大”、“减小”或“不变”,下同)
③若容积不变加入B,则A的转化率__________,B的转化率________。
④若升高温度,则平衡时B、C的浓度之比 将________。
将________。
⑤若加入催化剂,平衡时气体混合物的总物质的量________________________________
(2)在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
2NH3(g) ΔH<0。反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
在第5 min末将容器的体积缩小一半后,若在第8 min末达到新的平衡(此时NH3的浓度约为0.25 mol·L-1),请在图中画出第5 min末到平衡时NH3浓度的变化曲线。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com