
题目列表(包括答案和解析)
|
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:AgCl(s) Ksp(AgCl)=1 .8×10-10,Ksp(Ag2S)=6.3×10-50).下列说法正确的是:
| |
A. |
加入NaCl可以使溶液由a点变到b点 |
B. |
b点和d点均无AgCl沉淀生成 |
C. |
a点对应的Ksp大于c点对应的Ksp |
D. |
向0 .1 mol/L的硝酸银溶液中滴加0.1 mol/L的NaCl溶液至不再有白色沉淀生成,再向其中滴加0.1 mol/L的Na2S溶液,白色沉淀转化为黑色沉淀.其沉淀转化的反应方程式为:2AgCl(s)+S2-(aq)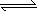 Ag2S(s)+2Cl-(aq). Ag2S(s)+2Cl-(aq).
|
|
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示( 提示:AgCl(s)Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50 ).下列说法正确的是:
| |
| [ ] | |
A. |
加入NaCl可以使溶液由a点变到b点 |
B. |
b点和d点均无AgCl沉淀生成 |
C. |
a点对应的Ksp大于c点对应的Ksp |
D. |
向0.1 mol/L的硝酸银溶液中滴加0.1 mol/L的NaCl溶液至不再有白色沉淀生成,再向其中滴加0.1 mol/L的Na2S溶液,白色沉淀转化为黑色沉淀. 其沉淀转化的反应方程式为: 2 AgCl(s)+S2-(aq) |
|
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示( 提示:AgCl(s)K sp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50).下列说法正确的是:
| |
| [ ] | |
A. |
加入NaCl可以使溶液由a点变到b点 |
B. |
b点和d点均无AgCl沉淀生成 |
C. |
a点对应的Ksp大于c点对应的Ksp |
D. |
向0.1 mol/L的硝酸银溶液中滴加0.1 mol/L的NaCl溶液至不再有白色沉淀生成,再向其中滴加0.1 mol/L的Na2S溶液,白色沉淀转化为黑色沉淀.其沉淀转化的反应方程式为:2 AgCl(s)+S2-(aq) |
硫化物通常有“废物”之称.硫化物据其溶解性可以分三类:
①易溶于水的有K2S、Na2S、(NH4)2S等;
②易溶于非氧化性强酸、不溶于水的有FeS、ZnS;
③大部分的硫化物既不溶于水也不溶于非氧化性强酸,如HgS、Ag2S、CuS、Cu2S.其中,Ag2S、CuS、Cu2S能溶于硝酸发生氧化还原反应,而HgS只能溶于王水(硝酸与盐酸的混合液).氢硫酸溶液中存在下列平衡:
H2S(1)K2S溶液显________性,原因________(用离子方程式表示)K2S溶液中离子浓度由大到小顺序________
(2)推测将硫化氢通入硫酸铜溶液中生成硫酸的原因是________
(3)在氢硫酸溶液中改变下列条件,使溶液中.c(OH-)、c(S2-)都增大的是________
A.加入少量的漂白粉
B.通入氨气
C.加入少量过氧化钠粉末
D.加入少量硝酸银溶液
(4)已知在常温下FeS的Ksp=6.25×10-18,H2S饱和溶液中c(H+)与cS2-)之间存在如下关系:c2(H+)·(S2-)=1.0×10-22.在该温度下,将适量FeS入硫化氢饱和溶液中,欲使溶液中(Fe2+)为1 mol/L,应调节溶液的c(H+)为________.
(1)如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。

①B中可通过________________判断可逆反应2NO2 N2O4已经达到平衡。
N2O4已经达到平衡。
②若平衡后在A容器中再充入0.5mol N2O4,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于____________________。
④若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
(2)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。

如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为:(x+1)S2-=SxS2-+2xe-,
则阴极的电极反应式是: 。
当反应转移xmol电子时,产生的气体体积为 (标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在
氮气气氛下溶解。其原因是(用离子反应方程式表示): 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com