
题目列表(包括答案和解析)
稀氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-
已知,25℃时溶液中存在下列关系:K=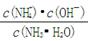 =1.8×10-5
=1.8×10-5
(1)向稀氨水中通入氨气时,平衡向 移动(用“右”、“左”填空,下同),向稀氨水中加入氢氧化钠时,平衡向 移动。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,所得溶液pH 7(填“>”、“<”或“=”),用离子方程式表示其原因: ;若向氨水中加入少量(NH4)2SO4固体,此时溶液中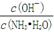 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(3)25℃时,若氨水的起始浓度为0.5 mol/L,平衡时溶液中c(OH-)=__________________,pH=______;向氨水中加入稀硫酸至溶液的pH=7时,c(NH4+)=a mol·L-1,假定HSO4—完全电离,则溶液中c(SO42—)= 。
稀氨水中存在下列平衡:NH3+H2O NH3·H2O
NH3·H2O NH4++OH-
NH4++OH-
已知,25℃时溶液中存在下列关系:K= =1.8×10-5
=1.8×10-5
(1)向稀氨水中通入氨气时,平衡向 移动(用“右”、“左”填空,下同),向稀氨水中加入氢氧化钠时,平衡向 移动。
(2)若向氨水中加入稀硫酸,使其恰好完全中和,所得溶液pH 7(填“>”、“<”或“=”),用离子方程式表示其原因: ;若向氨水中加入少量(NH4)2SO4固体,此时溶液中 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。
(3)25℃时,若氨水的起始浓度为0.5 mol/L,平衡时溶液中c(OH-)=__________________,pH=______;向氨水中加入稀硫酸至溶液的pH=7时,c(NH4+)=a mol·L-1,假定HSO4—完全电离,则溶液中c(SO42—)= 。
 NH3·H2O
NH3·H2O NH4++OH-
NH4++OH- =1.8×10-5
=1.8×10-5 (填“增大”、“减小”或“不变”)。
(填“增大”、“减小”或“不变”)。下列电离或离子方程式正确的是
A.亚硫酸的电离:H2SO3 2H++ SO3 2H++ SO3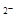 |
B.氯化铵水解的离子方程式为:NH4+ +H2O  NH3·H2O + H+ NH3·H2O + H+ |
C.NaHCO3水解的离子方程式为:HCO3-+H2O CO3 CO3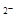 +H3O+ +H3O+ |
D.向氯化铝溶液中加入过量的氨水:A1 +3NH3·H2O= Al(OH)3↓+3NH4+ +3NH3·H2O= Al(OH)3↓+3NH4+ |
Mg(OH)2(s) ![]() Mg2++2OH- ①
Mg2++2OH- ①
NH![]() +H2O
+H2O![]() NH3·H2O+H+ ②
NH3·H2O+H+ ②
H++OH-![]() H2O ③
H2O ③
由于NH![]() 水解呈酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解。
水解呈酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解。
乙同学的解释是:
Mg(OH)2(s) ![]() Mg2++2OH- ①
Mg2++2OH- ①
NH![]() +OH-
+OH-![]() NH3·H2O ②
NH3·H2O ②
由于NH![]() 电离出的NH
电离出的NH![]() 与Mg(OH)2电离出的OH-结合生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
与Mg(OH)2电离出的OH-结合生成了弱电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确。你认为他选用的试剂是_________(填编号)。
A.NH4NO3 B.CH3COONH4
C.Na2CO3
D.NH3·H2O
(2)请你说明丙同学作出该选择的理由是___________________________。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解,由此推知,甲、乙哪位同学的解释更合理?_________(填甲或乙)。试写出NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式:__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com