
题目列表(包括答案和解析)
 (2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.
(2013?济南一模)目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝.| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 650 | 2 | 4 | 1.6 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 3 |
| 3 | 900 | 1 | 2 | 0.4 | 1 |
(共6分)实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:

|
实验次数 |
起始温度t1/℃ |
终止温度t2/℃ |
|
|
盐酸 |
NaOH溶液 |
||
|
1 |
20.2 |
20.3 |
23.7 |
|
2 |
20.3 |
20.5 |
23.8 |
|
3 |
21.5 |
21.6 |
24.9 |
完成下列问题:
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是 。
(2)在操作正确的前提下,提高中和热测定准确性的关键是 。
(3)根据上表中所测数据进行计算,则该实验测得的中和热ΔH= [盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将 (填“偏大”、“偏小”、 “不变”)。
(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热的数值偏低,请你分析可能的原因是
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.将50mL0.55mol/L氢氧化钠溶液取成了50mL0.55mol/L的氨水
E.在量取盐酸时仰视计数
F.大烧杯的盖板中间小孔太大
目前工业上有一种用CO2来生产燃料甲醇的方法,可以将CO2变废为宝。
(1)已知在常温常压下:
①2CH3OH(l)+3O2(g)= 2CO2(g)+4H2O(g) △H= _1275.6 kJ·mol-1
②2CO(g)+ O2(g)= 2CO2(g) △H= _556.0 kJ·mol-1
③H2O(l) = H2O(g) △H=+ 44.0 kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 。
(2)某同学利用甲醇燃料电池为电源,设计了一种电解法制取Fe(OH)2的实验装置(如图),通电后,溶液中产生大量的白色沉淀,且较长时间不变色。则电源中a极为 极(填“正”或“负”),其电极反应式为 。装置上端A极电极材料是 (填化学式),B电极上的电极反应式为 。

(3)将不同量的CO(g)和H2O(g)分别通入体积为2L的恒容密闭容器中,进行反应:CO(g) +H2O(g) CO2(g) + H2(g),得到如下三组数据:
CO2(g) + H2(g),得到如下三组数据:
|
实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
|
|
H2O |
CO |
CO2 |
|||
|
1 |
650 |
2 |
4 |
1.6 |
5 |
|
2 |
900 |
1 |
2 |
0.4 |
3 |
|
3 |
900 |
1 |
2 |
0.4 |
1 |
①该反应的正反应为 (填“吸”或“放”)热反应。
②实验1中,以v(H2)表示的平均反应速率为 。
③900℃时,按CO(g)、H2O(g)、CO2(g) 和 H2(g)的物质的量分别是0.8mol、1.0mol、0.6 mol和0.8 mol分别加入该容器,则此时反应的v(正) v(逆)(填“>”“<”或“=”中之一)。
④实验3跟实验2相比,改变的条件可能是 。
(8分)(2011·西宁模拟)甲醛是世界卫生组织(WHO)确认的致癌物质和致畸物质之一。我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组打算利用酸性KMnO4溶液测定新装修房屋内的空气中甲醛的含量,请你参与并协助他们完成相关的学习任务。
测定原理:
酸性KMnO4为强氧化剂,可氧化甲醛和草酸,其反应方程式如下所示:
4MnO4-+5HCHO+12H+===4Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
测定装置:
部分装置如下图所示:
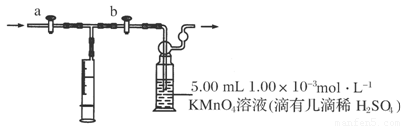
测定步骤:
(1)用______________量取5.00 mL 1.00×10-3mol·L-1KMnO4溶液,注入洗气瓶中,并滴入几滴稀H2SO4,加水20 mL稀释,备用。
(2)将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用。
(3)打开a,关闭b,用注射器抽取100 mL新装修房屋内的空气。关闭________,打开________(填“a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再重复4次。
(4)将洗气瓶中的溶液转移到锥形瓶中(包括洗涤液),再用草酸标准溶液进行滴定,记录滴定所消耗的草酸标准溶液的体积。
(5)再重复实验2次(每次所取的高锰酸钾溶液的体积均为5.00 mL)。3次实验所消耗的草酸标准溶液的体积平均值为12.38 mL。
交流讨论:
(1)计算该新装修房屋内的空气中甲醛的浓度为________mg·m-3,该新装修房屋内的甲醛________(填“是”或“否”)超标;
(2)某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设称量或量取、溶液配制及滴定实验均无错误)提出合理假设:______________、______________(至少答出两种可能性);
(3)实验结束后,该小组成员在相互交流的过程中一致认为:
①实验原理可以简化
实验中可不用草酸标准溶液滴定,可多次直接抽取新装修房屋内的空气,再推送到洗气瓶中,直至_________________________________________________________;
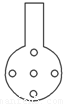
②实验装置应加以改进
可将插入酸性KMnO4溶液中的导管下端改成具有多孔的球泡(如图所示),有利于提高实验的准确度,其理由是___________________________________________________。
(8分)(2011·西宁模拟)甲醛是世界卫生组织(WHO)确认的致癌物质和致畸物质之一。我国规定:室内甲醛含量不得超过0.08mg·m-3。某研究性学习小组打算利用酸性KMnO4溶液测定新装修房屋内的空气中甲醛的含量,请你参与并协助他们完成相关的学习任务。
测定原理:
酸性KMnO4为强氧化剂,可氧化甲醛和草酸,其反应方程式如下所示:
4MnO4-+5HCHO+12H+===4Mn2++5CO2↑+11H2O
2MnO4-+5H2C2O4+6H+===2Mn2++10CO2↑+8H2O
测定装置:
部分装置如下图所示:
测定步骤:
(1)用______________量取5.00mL 1.00×10-3mol·L-1KMnO4溶液,注入洗气瓶中,并滴入几滴稀H2SO4,加水20mL稀释,备用。
(2)将1.00×10-3 mol·L-1的草酸标准溶液置于酸式滴定管中备用。
(3)打开a,关闭b,用注射器抽取100mL新装修房屋内的空气。关闭________,打开________(填“a”或“b”),再推动注射器,将气体全部推入酸性高锰酸钾溶液中,使其充分反应。再重复4次。
(4)将洗气瓶中的溶液转移到锥形瓶中(包括洗涤液),再用草酸标准溶液进行滴定,记录滴定所消耗的草酸标准溶液的体积。
(5)再重复实验2次(每次所取的高锰酸钾溶液的体积均为5.00mL)。3次实验所消耗的草酸标准溶液的体积平均值为12.38 mL。
交流讨论:
(1)计算该新装修房屋内的空气中甲醛的浓度为________mg·m-3,该新装修房屋内的甲醛________(填“是”或“否”)超标;
(2)某同学用该方法测量空气中甲醛的含量时,所测得的数值比实际含量低,请你对其可能的原因(假设称量或量取、溶液配制及滴定实验均无错误)提出合理假设:______________、______________(至少答出两种可能性);
(3)实验结束后,该小组成员在相互交流的过程中一致认为:
①实验原理可以简化
实验中可不用草酸标准溶液滴定,可多次直接抽取新装修房屋内的空气,再推送到洗气瓶中,直至_________________________________________________________;
②实验装置应加以改进
可将插入酸性KMnO4溶液中的导管下端改成具有多孔的球泡(如图所示),有利于提高实验的准确度,其理由是___________________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com