
题目列表(包括答案和解析)
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,则至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器(填序号) 。
|
名称 |
托盘天平(带砝码) |
小烧杯 |
坩埚钳 |
玻璃棒 |
药匙 |
量筒 |
|
仪器 |
|
|
|
|
|
|
|
序号 |
a |
b |
c |
d |
e |
f |
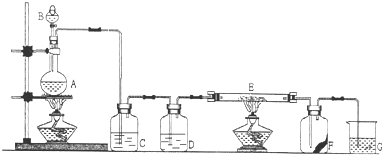
Ⅱ.测定中和热的实验装置如图所示

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ·mol-1):_______________________________________。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
|
温度 实验次数 |
超始温度t1/℃ |
终止温度t2/℃ |
平均温度差 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
|
2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
②根据上述实验数据计算出的中和热为53.5 kJ/mol,这与中和热的理论值57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)______。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度

(1)写出丙二醇的同分异构体___________(至少写出一种)。
(2)“亮菌甲素”可发生的化学反应类型有_________________(至少写出三种)。
(3)“亮菌甲素”与乙酸和浓硫酸加热可反应生成A,已知A分子可与浓溴水反应生成白色沉淀,写出“亮菌甲素”生成A的化学反应方程式____________。
(4)已知:①0.1 mol二甘醇与足量金属Na反应可生成2.
| 温度/℃ 溶解度/g 盐 |
0 | 10 | 20 | 30 | 40 | 50 | 60 |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| FeSO4?7H2O | 15.7 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)SO4FeSO4?6H2O | 12.5 | 17.2 | 21.6 | 28.1 | 33.0 | 40.0 | - |
| 起始铁的质量m1/g | 反应后铁的质量m2/g | 莫尔盐的质量 | 产率 | |
| 理论产量/g | 实际产量m3/g | |||
| 5.0 | 2.2 | c | 14.7 | d |
| ||
| ||
| ||
| ||
| 物质 | FeSO4 | H2SO4 | Ag2SO4 | Al2(SO4)2 | 污泥 |
| 质量分数/(%) | 15.0 | 7.0 | 0.40 | 0.34 | 5.0 |
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| FeSO4溶液度(g) | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 |
| Al2(SO4)3溶解度(g) | 31.2 | 33.5 | 36.4 | 40.4 | 45.7 | 52.2 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com