
题目列表(包括答案和解析)
(本题共8分)
β型硼氮化合物—-(BN)n是一种无机合成材料[最简式为(BN)],具有高硬度、耐高温的特点,是做超高温耐热陶瓷材料、磨料、精磨刃具的好材料。用硼砂(Na2B4O7)与尿素在高温高压下反应可以获得。例如: Na2B4O7+ 2CO(NH2)2 → 4(BN) + Na2O + 2CO2
(1)、请用氧化物的形式表示硼砂的化学式 。β型(BN)n比晶体硅具有更高硬度和耐热性的原因是: 。
(2)、(1)上述反应式中具有4种不同能量电子的原子,它代表的元素在周期表中处于 周
期,第 族。
(2)能用于比较N与O非金属性相对强弱的事实是 。
A.最高价氧化物对应水化物的酸性 B.H2O(g) 比NH3(g)稳定
C.单质与H2反应的难易程度 D.NO中氮元素显正价,氧元素显负价
(3)、写出指定分子的电子式:生成物中含极性键的非极性分子 。
(4)、与硼同主族且相邻周期的元素,其单质与NaOH(aq)反应的离子方程式为: 。
(本题共8分)
β型硼氮化合物—-(BN)n是一种无机合成材料[最简式为(BN)],具有高硬度、耐高温的特点,是做超高温耐热陶瓷材料、磨料、精磨刃具的好材料。用硼砂(Na2B4O7)与尿素在高温高压下反应可以获得。例如: Na2B4O7 + 2CO(NH2)2 → 4(BN) + Na2O + 2CO2
(1)、请用氧化物的形式表示硼砂的化学式 。β型(BN)n比晶体硅具有更高硬度和耐热性的原因是: 。
(2)、(1)上述反应式中具有4种不同能量电子的原子,它代表的元素在周期表中处于 周
期,第 族。
(2)能用于比较N与O非金属性相对强弱的事实是 。
A.最高价氧化物对应水化物的酸性 B.H2O(g) 比NH3(g)稳定
C.单质与H2反应的难易程度 D.NO中氮元素显正价,氧元素显负价
(3)、写出指定分子的电子式:生成物中含极性键的非极性分子 。
(4)、与硼同主族且相邻周期的元素,其单质与NaOH(aq)反应的离子方程式为: 。
A.生物质能是一种洁净、可再生能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式_________________________。
(2)根据等电子原理,写出CO分子的结构式______________________。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是_____________________;甲醛分子中碳原子轨道的杂化类型为_____________________。
②甲醛分子的空间构型是_____________________;1 mol甲醛分子中σ键的数目为_____________________。

③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为_____________________。
B.环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:

环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3, | 溶解性 |
环己醇 | 161.1(97.8)* | 0.962 4 | 能溶于水 |
环己酮 | 155.6(95)* | 0.947 8 | 微溶于水 |
水 | 100.0 | 0.998 2 |
|
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的ΔH<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧瓶中,在55~
①酸性Na2Cr2O7溶液的加料方式为_____________________。
②蒸馏不能分离环己酮和水的原因是_____________________。
(2)环己酮的提纯需要经过以下一系列的操作:a.蒸馏,收集151~
①上述操作的正确顺序是_______________________(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需_______________。
③在上述操作c中,加入NaCl固体的作用是_______________________________________
______________________________________________________________________________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有______________种不同化学环境的氢原子。
(9分) 超硬材料氮化铂是近年来的一个研究热点。它是在高温、超高压条件下合成的(50GPa、2000K)。由于相对于铂,氮原子的电子太少,衍射强度太弱,单靠X-射线衍射实验难以确定氮化铂晶体中氮原子数和原子坐标,2004年以来,先后提出过氮化铂的晶体结构有闪锌矿型、岩盐型(NaCl)和萤石型,2006年4月11日又有人认为氮化铂的晶胞如下图所示(图中的白球表示氮原子,为便于观察,该图省略了一些氮原子)。结构分析证实,氮是四配位的,而铂是六配位的;Pt―N键长均为209.6pm,N―N键长均为142.0 pm(对比:N2分子的键长为110.0pm)。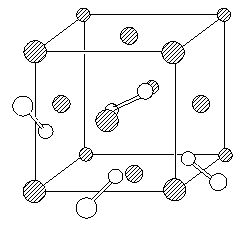 备用图
备用图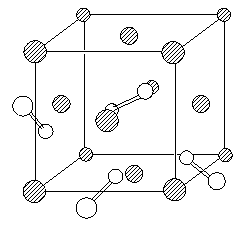
8-1 氮化铂的上述四种立方晶体在结构上有什么共同点?
8-2 分别给出上述四种氮化铂结构的化学式。
8-3 试在图上挑选一个氮原子,不添加原子,用粗线画出所选氮原子的配位多面体。
8-4请在本题的附图上添加六个氮原子(添加的氮请尽可能靠前)。
(10分)研究碳及其化合物的利用对促进低碳社会的构建具有重要的意义。某学习小组查阅资料并进行相关探究,请帮忙完成以下探究。
(1)pC类似于pH,是指极稀溶液中的溶质浓度的常用对数的负值。如某溶液中某溶质的浓度为1×10-3 mol/L,则该溶液中该溶质的pC=-lg(1×10-3)=3。如图为25℃时H2CO3溶液的pC-pH图。请回答下列问题:(若离子浓度小于10-5mol/L,可认为该离子不存在)
①在同一溶液中,H2CO3、HCO3-、CO32-________(填“能”或“不能”)大量共存。
②H2CO3一级电离平衡常数的数值Ka1 。
。
③人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)可以抵消少量酸或碱,维持pH 7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将 。
| A.变大 | B.变小 | C.基本不变 | D.无法判断 |

 CH3OH(g) +H2O(g) △H ;
CH3OH(g) +H2O(g) △H ;
| 容 器 | 甲 | 乙 |
| 反应物 投入量 | 1molCO2 3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com