
题目列表(包括答案和解析)
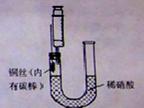
某同学利用如图装置制NO并进行相关实验探究。

(1)写出制备NO的反应方程式????????????????????????????????????? ?
(2)收集的气体与空气混合后变红色,这说明NO具有_____性。?
(3)制备NO的步骤如下:?
1按图所示连接好装置;
2取下注射器,通过U型长管加入稀硝酸至接近U型短管的铜丝?
3在针头上安装好注射器,抽出U型短管中的所有空气;然后拔出注射器,并排尽注射器中的空气。?
4待硝酸与铜丝分离后,用已排除空气的注射器抽出生成NO,将注射器针头插入橡皮塞中以封口。?
在上述操作中遗漏的一个步骤是???????????? ,在步骤3中可以观察到的现象为????????????????????? 。?????????????????????????
(4)在铜丝上绑上石墨的作用是????????????????????????????????? 。
(5)若将稀硝酸换成浓硝酸,则可制取NO2气体。请你用注射器收集NO2气体并完成“外界因素对化学平衡移动影响”实验探究,相关内容填在下面表格。(只完成一个影响因素的探究,其他实验用品自选)已知
2NO2(g)  N2O4(g) △H <0;N2O4为无色气体。?
N2O4(g) △H <0;N2O4为无色气体。?
实验步骤 | 实验现象 | 实验结论 |
①分别用两支注射器收集NO2,并将注射器针头插入橡皮塞中以封口。 ②_____________________ _______________________ ________________________ _______________________ ________________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ |
某同学利用如图装置制NO并进行相关实验探究。
(1)写出制备NO的反应方程式
(2)收集的气体与空气混合后变红色,这说明NO具有_____性。
(3)制备NO的步骤如下:
1按图所示连接好装置;
2取下注射器,通过U型长管加入稀硝酸至接近U型短管的铜丝
3在针头上安装好注射器,抽出U型短管中的所有空气;然后拔出注射器,并排尽注射器中的空气。
4待硝酸与铜丝分离后,用已排除空气的注射器抽出生成NO,将注射器针头插入橡皮塞中以封口。
在上述操作中遗漏的一个步骤是 ,在步骤3中可以观察到的现象为 。
(4)在铜丝上绑上石墨的作用是 。
(5)若将稀硝酸换成浓硝酸,则可制取NO2气体。请你用注射器收集NO2气体并完成“外界因素对化学平衡移动影响”实验探究,相关内容填在下面表格。(只完成一个影响因素的探究,其他实验用品自选)已知
2NO2(g)  N2O4(g) △H <0;N2O4为无色气体。
N2O4(g) △H <0;N2O4为无色气体。
| 实验步骤 | 实验现象 | 实验结论 |
| ①分别用两支注射器收集NO2,并将注射器针头插入橡皮塞中以封口。 ②_____________________ _______________________ ________________________ _______________________ ________________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ |
 N2O4(g) △H <0;N2O4为无色气体。
N2O4(g) △H <0;N2O4为无色气体。 | 实验步骤 | 实验现象 | 实验结论 |
| ①分别用两支注射器收集NO2,并将注射器针头插入橡皮塞中以封口。 ②_____________________ _______________________ ________________________ _______________________ ________________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ | _______________________ ________________________ _______________________ ________________________ _______________________ _______________________ ________________________ _______________________ |
| ||
| ||
| ||
| ||
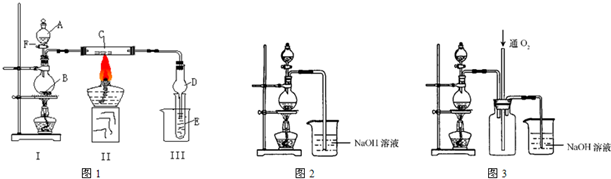
某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。

| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c的目的是__________________________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的化学方程式是____________________。再由a向c中加2 mL蒸馏水,c中的实验现象是________________________________________。
(3)上表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是____________________,理由是____________________。
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,操作步骤为________________,实验现象为________________,但此实验的不足之处是_______________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com