
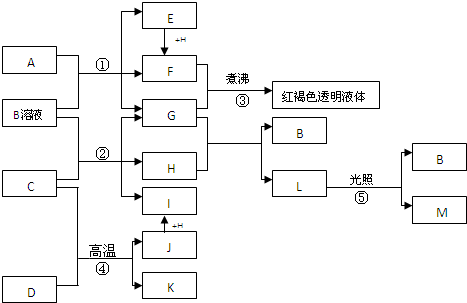
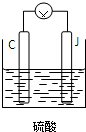
题目列表(包括答案和解析)
取等物质的量的MgO和Fe2O3 的混合物进行铝热反应,反应的化学方程式为 。
引发铝热反应的实验操作是 。
做铝热反应时,内层纸漏斗底部剪一小孔用水润湿的目的是
。
|
某集团所属铝母铸造分厂发生铝水外溢事故,共造成9人死亡、64人受伤.关于金属铝,下列说法正确的是 | |
| [ ] | |
A. |
冶炼金属铝时铝水温度极高,如外溢极易引发事故 |
B. |
等量的铝分别与足量的盐酸和氢氧化钠溶液反应,消耗酸和碱的物质的量之比为1∶2 |
C. |
将一铝片投入浓硫酸中没有气体产生,说明铝不与浓硫酸反应 |
D. |
发生铝热反应时,铝被置换出来 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com