
题目列表(包括答案和解析)
改变的条件 正反应速率 对平衡的影响 SO2的转化率
(1)增大O2浓度
(2)增大SO2浓度
(3)减小SO3浓度
(4)同等倍数增大
各物质的浓度
(5)升高温度
(6)使用催化剂
(7)体积不变充入氖气
在500℃时,2SO2+O2ƒ2SO3(g)的平衡体系里,若只改变下列条件,请把影响结果填入下表。
改变的条件 正反应速率 对平衡的影响 SO2的转化率
(1)增大O2浓度
(2)增大SO2浓度
(3)减小SO3浓度
(4)同等倍数增大
各物质的浓度
(5)升高温度
(6)使用催化剂
(7)体积不变充入氖气
| |||||||||||||||||||||||||
在一个固定体积的密闭容器中,向容器中充入2 mol A和1 mol B,发生如下反应:2A(g)+B(g)![]() 3C(g)+D(s),反应达到平衡时C的浓度为1.2 mol/L.
3C(g)+D(s),反应达到平衡时C的浓度为1.2 mol/L.
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为________(填“吸热”或“放热”)反应.
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是________(用序号填空)
①4 mol A+2 mol B
②3 mol C+1 mol D+l mol B
③3 mol C+2 mol D
④1.6 mol A+0.8 mol B+0.6 mol C
(3)某温度下,向容器中加入3 mol C和0.8 mol D,反应达到平衡时C的浓度仍为1.2 mol/L,则容器的容积V应大于________L,小于________L.
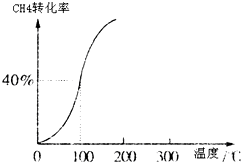 Ⅰ、合成氨对农业生产及国防建设均具有重要意义.
Ⅰ、合成氨对农业生产及国防建设均具有重要意义. ,其他条件不变,对平衡体系产生的影响是______(填字母序号).
,其他条件不变,对平衡体系产生的影响是______(填字母序号).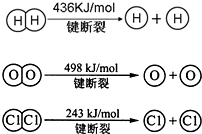
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com