
题目列表(包括答案和解析)
A.滤液中一定有Fe2+ B.滤液中一定有Fe3+
C.滤液中一定有Fe2+、Cu2+ D.滤液中一定有Fe2+、Fe3+、Cu2+
| A、原混合物中铜和铁各0.075mol | B、稀硝酸的物质的量浓度为0.5mol?L-1 | C、第一次剩余4.8g金属为铜和铁 | D、再加入上述100mL稀硝酸,又得到标准状况下1.12L NO |
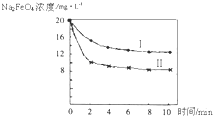 (2012?朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
(2012?朝阳区一模)高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂.工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下: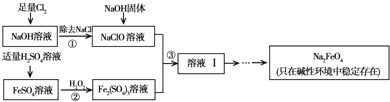


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com