(2010?天河区一模)天然大理石通常含有Fe
2O
3等杂质,工业上用大理石作原料时需要提纯,某研究性学习小组在老师的指导下,对大理石进行了提纯,设计了如下的实验步骤:
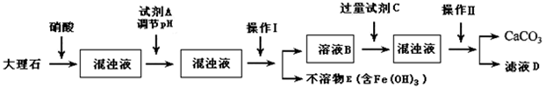
请回答下列问题:
(1)溶解大理石时,用硝酸而不用硫酸的原因是
硫酸钙微溶于水
硫酸钙微溶于水
.
(2)使用试剂A(溶质是共价化合物)调节pH值目的是让溶液中Fe
3+沉淀完全,则试剂A是
氨水,
氨水,
,试剂C为铵的正盐,则C是
碳酸铵
碳酸铵
.
(3)操作I的名称是
过滤
过滤
,该操作中用到玻璃棒,玻璃棒在该实验中的作用是
引流
引流
.
(4)检验溶液B中是否含铁离子的操作方法是
取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe
3+
,溶液变红色,说明滤液中含Fe
3+取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe
3+
,溶液变红色,说明滤液中含Fe
3+.
(5)为了分析大理石中铁元素的含量,准确称取大理石,然后再将不溶物E预处理,使铁元素还原成Fe
2+,再用KMnO
4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe
2++MnO
4-+8H
+═5Fe
3++Mn
2++4H
2O
①滴定前是否要滴加指示剂?
否
否
(填“是”或“否”),请说明理由
KMnO4溶液的紫红色可指示反应终点
KMnO4溶液的紫红色可指示反应终点
.
②滴定时用
b
b
(填仪器编号)盛装KMnO
4标准溶液.若定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果
偏高
偏高
(填“偏高”或“偏低”或“不变”).


 ,溶液变红色,说明滤液中含Fe3+
,溶液变红色,说明滤液中含Fe3+ ,溶液变红色,说明滤液中含Fe3+
,溶液变红色,说明滤液中含Fe3+