
题目列表(包括答案和解析)

| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 589 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 589 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 589 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
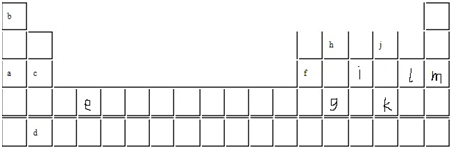
“椅子形状”的图包含了元素周期表前四周期的部分元素,其中A、B、C、D四种元素原子序数之和为77。
(1)写出A、B、C的价电子构型的电子排布式 。
(2)G原子的最外层电子占有 种能量不同的轨道。
(3)F形成的气态氢化物的电子式 。E和F简单气态氢化物的稳定性较强的是 (写化学式)。
(4)A、B两元素都可以与氧元素形成化合物OA2、B2O,其分子的空间构型为折线型分子,对它们分子极性的判断正确的是( )。
a.都为非极性分子 b.都为极性分子 c.无法确定
在两种化合物中元素A、B的化合价分别为A ,B 。
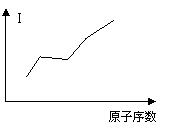 (5)气态原子失去一个电子所需要吸收的
(5)气态原子失去一个电子所需要吸收的
能量叫做第一电离能(I)。G、E、D、B四种
原子的第一电离能大小变化如右图所示:
同一周期元素的气态原子的第一电离能
与原子半径的关系 。
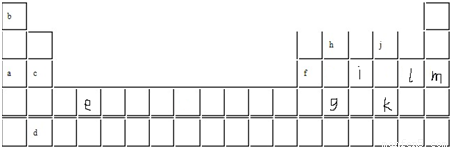
“椅子形状”的图包含了元素周期表前四周期的部分元素,其中A、B、C、D四种元素原子序数之和为77。
(1)写出A、B、C的价电子构型的电子排布式 。
(2)G原子的最外层电子占有 种能量不同的轨道。
(3)F形成的气态氢化物的电子式 。E和F简单气态氢化物的稳定性较强的是 (写化学式)。
(4)A、B两元素都可以与氧元素形成化合物OA2、B2O,其分子的空间构型为折线型分子,对它们分子极性的判断正确的是( )。
a.都为非极性分子 b.都为极性分子 c.无法确定
在两种化合物中元素A、B的化合价分别为A ,B 。
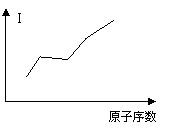 (5)气态原子失去一个电子所需要吸收的
(5)气态原子失去一个电子所需要吸收的
能量叫做第一电离能(I)。G、E、D、B四种
原子的第一电离能大小变化如右图所示:
同一周期元素的气态原子的第一电离能
与原子半径的关系 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com