
题目列表(包括答案和解析)
下列事实不能用勒沙特列原理解释的是( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③把pH=2的NaHSO4溶液加水稀释至10倍,c(OH-)却上升了10倍
④常温下,将1 mL pH=3的醋酸溶液加水稀释至l00 mL,测得其pH<5
⑤在滴有酚酞的Na2CO3溶液中滴CaCl2溶液,生成沉淀的同时溶液颜色由红逐渐变无
⑥对于H2+I2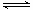 2HI的平衡体系,加压后密闭体系中的混合气体密度增加
2HI的平衡体系,加压后密闭体系中的混合气体密度增加
⑦在双氧水的分解实验中添加MnO2能使分解速率显著加快
A、①③④ B、②⑥⑦ C、③④⑤ D、②③⑤
下列事实不能用勒沙特列原理解释的是( )
①氯化铁溶液加热蒸干最终得不到氯化铁固体
②铁在潮湿的空气中容易生锈
③把pH=2的NaHSO4溶液加水稀释至10倍,c(OH-)却上升了10倍
④常温下,将1 mL pH=3的醋酸溶液加水稀释至l00 mL,测得其pH<5
⑤在滴有酚酞的Na2CO3溶液中滴CaCl2溶液,生成沉淀的同时溶液颜色由红逐渐变无
⑥对于H2+I2 2HI的平衡体系,加压后密闭体系中的混合气体密度增加
2HI的平衡体系,加压后密闭体系中的混合气体密度增加
⑦在双氧水的分解实验中添加MnO2能使分解速率显著加快
| A.①③④ | B.②⑥⑦ | C.③④⑤ | D.②③⑤ |
 2HI的平衡体系,加压后密闭体系中的混合气体密度增加
2HI的平衡体系,加压后密闭体系中的混合气体密度增加| A.①③④ | B.②⑥⑦ | C.③④⑤ | D.②③⑤ |
(18分) 三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:
第一组:烧瓶中盛装滴有酚酞的 Na2SO3溶液,并放置在盛有水的烧杯中,然后向烧杯中加入浓硫酸,实验过程中发现烧瓶中溶液红色_____(填“变深”、“变浅”或“不变”),下列有关叙述正确的是_________(填字母)。
A.溶液显浅红色是因为Na2SO3水解呈酸性 B.水解反应为放热反应
C.水解反应为吸热反应 D.升高温度,Na2SO3水解程度增大
第二组:该小组讨论Fe3+和SO32-之间发生怎样的反应,提出了三种假设:①是发生氧化还原反应:2Fe3++SO32-+ H2O = 2Fe2++ SO42-+ 2H+;②是发生双水解反应:2Fe3++ 3SO32-+ 6H2O =2Fe(OH)3(胶体) + 3H2SO3;③是两种反应同时发生。为了验证假设,同学们进行了下列实验,请填写下列空白:
(1) 用试管取适量Na2SO3溶液,加入BaCl2稀溶液,有白色沉淀生成,再加稀盐酸,沉淀全部溶解,然后再进行后续实验。该实验操作的目的是______________________。
(2) 取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3溶液至过量,溶液颜色最终变为红褐色。这种红褐色液体是__________________。向红褐色液体中加足量盐酸,将所得溶液分成两份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为________________________;另一份加入BaCl2稀溶液,产生少量白色沉淀,白色沉淀为________(填化学式)。
(3) 由上述实验现象说明假设__________(填编号)是正确的。
第三组:用0.1000mol/L的酸性KMnO4溶液滴定未知浓度的Na2SO3溶液,用碱式滴定管量取25.00mL Na2SO3溶液于锥形瓶,用_____式滴定管盛装KMnO4溶液进行滴定,滴定终点颜色变化为:_____色变为_____色;重复三次实验,测得消耗的KMnO4溶液体积平均值为20.00mL,则Na2SO3的浓度为____________mol/L。
(18分) 三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:
第一组:烧瓶中盛装滴有酚酞的 Na2SO3溶液,并放置在盛有水的烧杯中,然后向烧杯中加入浓硫酸,实验过程中发现烧瓶中溶液红色_____(填“变深”、“变浅”或“不变”),下列有关叙述正确的是_________(填字母)。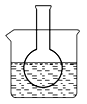
| A.溶液显浅红色是因为Na2SO3水解呈酸性 | B.水解反应为放热反应 |
| C.水解反应为吸热反应 | D.升高温度,Na2SO3水解程度增大 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com