
题目列表(包括答案和解析)
 某学生用0.1000mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测溶液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20 | 1.02 | 21.03 |
| 2 | 20 | 2.00 | 25.00 |
| 3 | 20 | 0.60 | 20.6 |
| 滴定次数 | 待测溶液体积/ml | 标准溶液的体积/ml | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20 | 1.02 | 21.03 |
| 2 | 20 | 2.00 | 25.00 |
| 3 | 20 | 0.60 | 20.6 |
| 滴定次数 | 待测溶液体积/ml | 标准溶液的体积/ml | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20 | 1.02 | 21.03 |
| 2 | 20 | 2.00 | 25.00 |
| 3 | 20 | 0.60 | 20.6 |
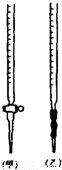
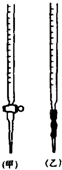
某学生有0.1000mol/L KOH溶液滴定未知尝试的盐酸溶液,其操作可分解为如下几步:
(A)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(E)调节液面至0或0刻度以下,记下读数
(F)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(A)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)实验中用左手控制____________(填仪器及部位),眼睛注视____________________,直至滴定终点。判断到达终点的现象是________________________________________。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并有来滴定上述盐酸,则对测定结果的影响是___________________________________________________-。
(6)滴定结束后如仰视观察滴定管中液面刻度,则对滴定结果的影响是______________。
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(OH)n(SO4)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾K2FeO4是一种新型、高效、多功能绿色水处理剂,某化学探究小组设计如下方案制备上述两种产品,请回答下列问题:

(1)若A物质为水,一定条件下可得铁的固体氧化物Fe3O4,检验Fe3O4中铁的化合价,应使用的试剂是 (填标号)。
A.稀硫酸 B.稀硝酸 C.KSCN溶液 D.酸性高锰酸钾溶液
(2)在溶液Ⅰ中加入NaClO3,写出其氧化Fe2+的离子方程式 。
(3)Fe2O3与KNO3和KOH的混合物加热共融可制得K2FeO4。完成并配平下列化学方程式:
![]()
该反应中的氧化剂是 ,每生成1mol K2FeO4转移 mol电子。
(4)为测定溶液I中铁元素的总含量,实验操作:准确量取20.00mL溶液I于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000mol·L-1 Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-=2Fe2++I2 I2+2S2O32-=2I-+S4O62-
①写出滴定选用的指示剂 ,滴定终点观察到的现象 。
②溶液I中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会 (填“偏高”、“偏低”、“不变”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com