
题目列表(包括答案和解析)
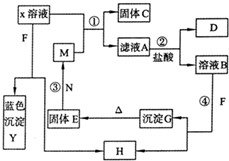 (2009?滨州模拟)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色.各物质的转化关系如图(部分反应产物已略去).
(2009?滨州模拟)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色.各物质的转化关系如图(部分反应产物已略去).(12分)已知X为中学化学中一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的氧化物可作耐火材料,可用它来制造耐火坩埚和耐高温试验仪器;H为气体单质,D为无色气体,D在空气中会出现红棕色。各物质的转化关系如X下图(部分反应产物已略去)。

请回答下列问题;
(1) E的化学式为
(2) 将M丝插入盛有X溶液的试管中,反应一段时间后的现象是 。
(3) 在反应①②③④中属于置换反应的是 (填序号)
(4) 反应②的离子方程式为 。
(5) 用石墨作电极点解500mLX溶液,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;点解一段时间后,取出A电极,洗涤、干燥、称量,电极增重1.6g。请回答下列问题:
①写出点解时的阳极反应式 。
②电解后溶液的pH为 (假设电解前后溶液体积不变)。
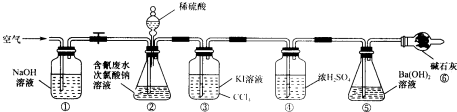
| 实验 | c(H2SO4)mol.L-1 | V(H2SO4)mL | V(NaClO)mL | 含氯废水的体积mL |
| 1 | 100 | 100 | ||
| 2 | 0.0500 | 100 | 100 | |
| 3 | 0.2000 | 100 | 100 |
(12分) 工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。
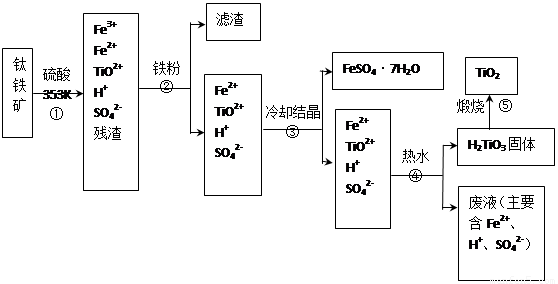
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为 。
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号)。a. 熔沸点差异 b. 溶解性差异 c. 氧化性、还原性差异
(3)步骤②、③、④中,均需用到操作是 (填操作名称)。
(4)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),则反应的离子方程式为 。
(5)研究发现,可以用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
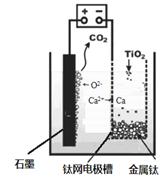
①写出阳极所发生反应的电极反应式: 。
②在制备金属钛前后,CaO的总量不变,其原因是
(请结合化学用语解释)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com