
题目列表(包括答案和解析)
(14分)我国化学家侯德榜根据NaHCO3的溶解度比NaCl、Na2CO3、NH4C1都小的性质,运用![]() 等反应原理,发明了“侯氏制碱法”。
等反应原理,发明了“侯氏制碱法”。
根据侯德榜制碱法原理,实验室用食盐、氨水、犬理石、盐酸制取碳酸钠。其实验过程如下:
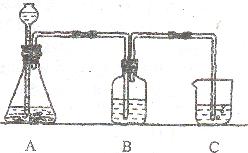 ①配制含氨的氯化钠饱和溶液;②用石灰石和稀盐酸制取纯净的CO2;③将CO2通入NaCl的氨溶液中,得到碳酸氢钠晶体:④过滤,冷水洗涤沉淀;⑤焙烧NaHCO3得到Na2CO3。
①配制含氨的氯化钠饱和溶液;②用石灰石和稀盐酸制取纯净的CO2;③将CO2通入NaCl的氨溶液中,得到碳酸氢钠晶体:④过滤,冷水洗涤沉淀;⑤焙烧NaHCO3得到Na2CO3。
试回答下列问题:
(1)某学生将实验步骤④、③、③设计成下图所示的装置:洗气瓶B中的液体是 ,烧杯C中的液体是 。
(2)实验步骤④中洗涤沉淀的目的是 。
(3)该学生设计右图所示装置进行NaHCO3的分解,并证实产物中有C02产生。
① 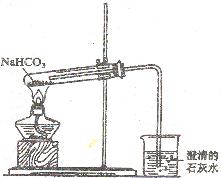 试管中发生的化学反应方程式是:
试管中发生的化学反应方程式是:
②指出该学生设计的装置图的错误之处.并改正(文字说明即可)。
③停止加热时应该怎样操作,为什么?
④烧杯中发生反应的离予方程式是:
| ||
| ||
| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1.4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
| 实验步骤 | 实验操作 | 实验操作的目的 |
| 步骤1 | 加入H2O2 加入H2O2 |
把二价铁氧化成三价 把二价铁氧化成三价 |
| 步骤2 | 加入适量氧化铜,调节pH到3.7 加入适量氧化铜,调节pH到3.7 |
保证三价铁完全沉淀 保证三价铁完全沉淀 |
| 步骤3 | 过滤 过滤 |
滤出氢氧化铁 滤出氢氧化铁 |
| 步骤4 | 洗涤 | 除去杂质 除去杂质 |
| 步骤5 | 向沉淀中加入适量稀硫酸和适量铁粉 向沉淀中加入适量稀硫酸和适量铁粉 |
得到FeSO4溶液 |
| 144n |
| 64m |
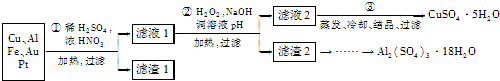
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 5.8 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 8.8 | 3.2 | 5.2 | 6.7 |
2- 3 |
2- 6 |
| 1 |
| 4 |
| 编号 | 操作方法 | 实验目的 |
| A | 向干燥试管A中放入干燥的铁钉,并用橡皮塞塞上 向干燥试管A中放入干燥的铁钉,并用橡皮塞塞上 |
探究铁在干燥空气中的生锈情况 |
| B | 放入铁钉,注入蒸馏水浸没铁钉,并用植物油液封 | 探究铁钉在水中的生锈情况 探究铁钉在水中的生锈情况 |
| C | 将铁钉放入试管C中,加入蒸馏水浸没铁钉一半,敞口放置 将铁钉放入试管C中,加入蒸馏水浸没铁钉一半,敞口放置 |
探究铁在有空气和水封时的生锈情况 |
(9分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀H2SO425.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25.00 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2~3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。 E.检查滴定管是否漏水。 F.另取锥形瓶,再重复操作一次。 G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
a、滴定操作的正确顺序是(用序号填写): 。
b、该滴定操作中应选用的指示剂是: 。
c、在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果精确到小数点后二位) mol/L
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com