
题目列表(包括答案和解析)
(10分)按要求在下列空格中写出下列有机物的有关式子及有关反应方程式并注明反应类型
(1)最简单烯烃的电子式: ,
(2)相对分子质量最小的有机物结构式: ,
(3)食醋中的有机物结构式: ,
(4)乙烯与氯化氢反应:方程式: ,反应类型
(5)在浓硫酸作用下,苯与浓硝酸在60℃反应方程式: ,反应类型
(10分)按要求在下列空格中写出下列有机物的有关式子及有关反应方程式并注明反应类型
(1)最简单烯烃的电子式: ,
(2)相对分子质量最小的有机物结构式: ,
(3)食醋中的有机物结构式: ,
(4)乙烯与氯化氢反应:方程式: , 反应类型
(5)在浓硫酸作用下,苯与浓硝酸在60℃反应方程式: , 反应类型
| 物 质 | 熔点(℃) | 沸点(℃) | 密度(g/cm3) |
| 乙 醇 | -117.0 | 78.0 | 0.79 |
| 乙 酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸(98%) | - | 338.0 | 1.84 |
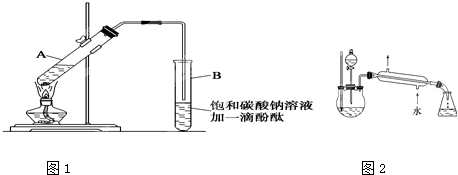
 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O实验室可以通过以下三条途径和要求制取N2
Ⅰ、加热条件下用NH3还原CuO得纯净N2和活性Cu粉
Ⅱ、将空气通过活性Cu粉得到较为纯净的N2
Ⅲ、加热NaNO2(有毒、致癌)和NH4Cl的浓溶液制N2

上面给出了按上述途径制氮气可供选择的几种仪器,其它必要仪器如:铁架台、酒精灯等未画出
(1)按途径Ⅰ制N2时需要的氨气用浓氨水与生石灰作原料制取,最好采用上述仪器中的________(填仪器代码)作氨气发生装置,该发生装置中发生反应的化学方程式是________和________.
要制取并收集纯净的N2(允许含少量水蒸气),还使用到上述仪器中(按气流从左到右的顺序用a、b、c、d…等列出)________接________,________接________,________接________.
(2)按途径Ⅱ制取纯净的N2(允许含少量水蒸气),对原料气空气中的CO2要予先除去,写出除去CO2所发生的化学反应方程式为________.
(3)上述制取N2的三条途径,Ⅰ、Ⅲ两条途径常便用而越来越受到人们的关注,方法Ⅰ与Ⅲ相比其优越性在于________________________________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com