
题目列表(包括答案和解析)
为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。




(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。
装置A中能产生二氧化碳的化学方程式为 。
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。
重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定。
(5Fe2+ + MnO4—+ 8H+ ==5Fe3+ + Mn2+ + 4H2O)。
测定铁元素质量分数的实验步骤如下:
I.往烧瓶A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
II.将滤液B稀释为250 mL;
III.取稀释液25.00 mL,用浓度为c mol·L—1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 ;
②丙同学设计了下列滴定方式(夹持仪器省略),最合理的是 。(填字母序号)

③滴定过程中 (填“需要”或“不需要”)加入指示剂,如需要,应加入的指示剂是 。
④铁碳合金中铁元素的质量分数为 。
为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了下图所示的实验装置,并完成以下实验探究。
|
|

 (1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
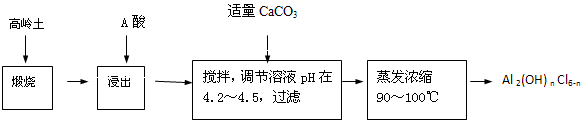
(20分)聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭 土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:
已知:Fe3+、Al3+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2。
根据流程图回答下列问题:
(1)“煅烧”的目的是_______________________________________________。
(2)“浸出”过程中发生反应的离子方程式为_______________________________。
(3)“浸出”选用的酸为_______。配制质量分数15%的A酸需要200mL30%的A酸(密度约为1.15g/cm3)和_______g蒸馏水,配制用到的仪器有烧杯、玻璃棒、______________。
(4)为提高铝的浸出率,可采取的措施有 _______________(要求写出三条)。
(5)“调节溶液pH在4.2~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_________________;“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是___________ ______。
(6)实验中制备碱式氯化铝反应的化学方程式为_________________
(20分)聚合氯化铝是一种新型、高效絮凝剂和净水剂,其单体是液态的碱式氯化铝[Al2(OH)nCl6-n]。本实验采用铝盐溶液水解絮凝法制备碱式氯化铝。其制备原料为分布广、价格廉的高岭 土,化学组成为:Al2O3(25%~34%)、SiO2(40%~50%)、Fe2O3(0.5%~3.0%)以及少量杂质和水分。已知氧化铝有多种不同的结构,化学性质也有差异,且一定条件下可相互转化;高岭土中的氧化铝难溶于酸。制备碱式氯化铝的实验流程如下:
已知:Fe3+、Al3+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、5.2。
根据流程图回答下列问题:
(1)“煅烧”的目的是_______________________________________________。
(2)“浸出”过程中发生反应的离子方程式为_______________________________。
(3)“浸出”选用的酸为_______。配制质量分数15%的A酸需要200mL30%的A酸(密度约为1.15g/cm3)和_______g蒸馏水,配制用到的仪器有烧杯、玻璃棒、______________。
(4)为提高铝的浸出率,可采取的措施有 _______________(要求写出三条)。
(5)“调节溶液pH在4.2~4.5”的过程中,除添加必要的试剂,还需借助的实验用品是_________________;“蒸发浓缩”需保持温度在90~100℃,控制温度的实验方法是___________ ______。
(6)实验中制备碱式氯化铝反应的化学方程式为_________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com