
题目列表(包括答案和解析)
(16分)
运用化学反应原理研究氮、氧等元素的单质及其化合物的反应有重要意义。
Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g) 2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。
(2)在一定温度和压强下,已知:
O2 (g) = O2+(g) + e-;![]() H1= 1175.7 kJ/mol
H1= 1175.7 kJ/mol
PtF6 (g) + e-= PtF6- (g);![]() H2= ―771.1 kJ/mol
H2= ―771.1 kJ/mol
O2PtF6 (s)= O2+ (g) + PtF6- (g); H3=482.2 kJ/mol
H3=482.2 kJ/mol
则反应O2 (g) + PtF6 (g) =O2PtF6 (s);![]() H=_____________ kJ/mol。
H=_____________ kJ/mol。
Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)⑤、⑥溶液比较,pH较大的是 。
(2)六种溶液中,水的电离程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,则消耗溶液的体积:②________ ③(选填“>”、“<”或“=”)。
(4)稀释相同倍数后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”)。
(16分)
运用化学反应原理研究氮、氧等元素的单质及其化合物的反应有重要意义。
Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g)  2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡
(填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH
(填“增大”、“减小”或“不改变”)。
2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡
(填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH
(填“增大”、“减小”或“不改变”)。
 (2)在一定温度和压强下,已知:
(2)在一定温度和压强下,已知:
O2 (g) = O2+
(g) + e-;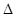 H1= 1175.7 kJ/mol
H1= 1175.7 kJ/mol
PtF6 (g) + e-
= PtF6- (g);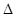 H2= ―771.1 kJ/mol
H2= ―771.1 kJ/mol
 O2PtF6 (s)
= O2+ (g) + PtF6- (g);
O2PtF6 (s)
= O2+ (g) + PtF6- (g); H3=
482.2 kJ/mol
H3=
482.2 kJ/mol
则反应O2 (g) + PtF6 (g) =
O2PtF6 (s);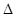 H=_____________ kJ/mol。
H=_____________ kJ/mol。
 Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01
mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01
mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)⑤、⑥溶液比较,pH较大的是 。
(2)六种溶液中,水的电离程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,则消耗溶液的体积:②________ ③(选填“>”、“<”或“=”)。
(4)稀释相同倍数后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”)。
(16分)
运用化学反应原理研究氮、氧等元素的单质及其化合物的反应有重要意义。 Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g)
Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g)  2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。
2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡 (填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH (填“增大”、“减小”或“不改变”)。 (2)在一定温度和压强下,已知:
(2)在一定温度和压强下,已知:
O2 (g) = O2+ (g) + e-; H1=" 1175.7" kJ/mol
H1=" 1175.7" kJ/mol PtF6 (g) + e- = PtF6- (g);
PtF6 (g) + e- = PtF6- (g); H2=" ―771.1" kJ/mol
H2=" ―771.1" kJ/mol O2PtF6 (s) = O2+ (g) + PtF6- (g);
O2PtF6 (s) = O2+ (g) + PtF6- (g);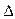 H3=" 482.2" kJ/mol
H3=" 482.2" kJ/mol 则反应O2 (g) + PtF6 (g) = O2PtF6(s);
则反应O2 (g) + PtF6 (g) = O2PtF6(s); H="_____________" kJ/mol。
H="_____________" kJ/mol。 Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)⑤、⑥溶液比较,pH较大的是 。
(2)六种溶液中,水的电离程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,则消耗溶液的体积:②________ ③(选填“>”、“<”或“=”)。
(4)稀释相同倍数后,溶液的pH:① ②,③ ④(选填“>”、“<”或“=”)。
(1)有五瓶溶液分别是①10毫升0.60mol/LNaOH水溶液 ②20毫升0.50mol/L硫酸水溶液 ③30毫升0.40mol/LHCl溶液 ④40毫升0 .30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
.30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
(2)水的电离平衡如图所示.

①若A点表示25℃时水的电离平衡状态,当升高温度
至100℃时水的电离平衡状态为B点,则此时水的离子积为 。
②将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
③已知AnBm的离子积=c(Am+)n?c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74g,其饱
和溶液的密度为1g/mL,其离子积为 。
(3)现有常温下0.1 mol·L—1的纯碱溶液。
①下列纯碱溶液中离子浓度之间的关系正确的是 。
| A.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-) |
| B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| D.c(CO32-)=c(HCO3-)+c(H2CO3) |
 。
。(1)有五瓶溶液分别是①10毫升0.60mol/LNaOH水溶液 ②20毫升0.50mol/L硫酸水溶液 ③30毫升0.40mol/LHCl溶液 ④40毫升0.30mol/LCH3COOH水溶液 ⑤50毫升0.20mol/L蔗糖水溶液。以上各瓶溶液所含离子、分子总数的大小顺序是__________ _。
(2)水的电离平衡如图所示.

①若A点表示25℃时水的电离平衡状态,当升高温度
至100℃时水的电离平衡状态为B点,则此时水的离子积为 。
②将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为 。
③已知AnBm的离子积=c(Am+)n•c(Bn-)m,若某温度下Ca(OH)2的溶解度为0.74g,其饱
和溶液的密度为1g/mL,其离子积为 。
(3)现有常温下0.1 mol·L—1的纯碱溶液。
①下列纯碱溶液中离子浓度之间的关系正确的是 。
A.c(H+)+c(Na+)=c(OH-)+c(HCO3-)+2c(CO32-)
B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
C.c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.c(CO32-)=c(HCO3-)+c(H2CO3)
②纯碱溶液呈碱性,其原因是(用离子方程式表示) ,
验证纯碱溶液呈碱性的实验方法(简述操作过程): 。
③纯碱溶液与氯化铝溶液混合有大量泡沫生成,其原因是(用离子方程式表示) 。
④某同学认为纯碱溶液中Na2CO3的水解是微弱的,发生水解的CO32-不超过其总量的
10%。请你设计实验证明该同学的观点是否正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com