|
Ⅰ、有A、B、C、D、E五种溶液分别是HCl、NH3·H2O、NH4HSO4、NaOH、CH3COOH,回答下列问题:
(1)用水稀释0.1 mol/LB时,溶液中随着水量的增加而减小的是(填写序号)
a.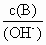
b.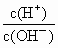
c.c(H+)·c(OH-)
d.n(OH-)
(2)pH相同的等体积的两份溶液A和E,分别与镁粉反应,若最后仅有一份溶液中存在镁粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)
a.反应所需要的时间E>A
b.开始反应时的速率A>E
c.参加反应的镁粉物质的量A=E
d.E溶液里有镁粉剩余
(3)将等体积、等物质的量浓度B和C混合后溶液,升高温度(溶质不会分解),溶液pH随温度变化如下图中________曲线(填写序号).
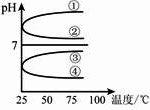
(4)室温下,向0.01 mol/L C溶液中滴加0.01 mol/L D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为________.
Ⅱ、下表是不同温度下水的离子积数据:
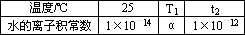
试回答以下问题:
(1)若25<t1<t2,则α________(填“<”“>”或“=”)1×10-14,作出此判断的理由是________.
(2)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为________.
(3)FeCl3的水溶液呈________(填“酸”、“中”、“碱”)性,t2℃时的pH________6(填“>”、“=”、“<”),原因是(用离子方程式表示):________,实验室在配制FeCl3的溶液时,常将FeCl3固体先溶于________中,然后再用蒸馏水稀释到所需的浓度,以________(填“促进”、“抑制”)其水解,否则得到的是浑浊的溶液.
| 