
题目列表(包括答案和解析)
| 实验步骤 | 实验现象 |
| I.向编号为①②③的3支试管中,分别加入1mL 20%的蔗糖溶液,向试管②和③中加入0.5mL稀硫酸,并将这3支试管同时水浴加热约5min | 均无明显现象 |
| II.取试管①和②,加入新制氢氧化铜悬浊液,加热至沸腾 | 均无明显现象 |
| III.取试管③,先加入NaOH溶液调溶液pH至碱性,再加入新制氢氧化铜悬浊液,加热至沸腾 | |
| 结论:证明蔗糖在稀硫酸作用下发生了水解反应 | |
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
| A.分液 | B.过滤 | C.洗气 | D.蒸馏 |
| | 混合物 | 需加入的试剂 | 分离方法 |
| ① | 1一氯丙烷 (乙醇) | | |
| ② | 乙烷 (乙烯) | | |
| ③ | 溴化钠溶液(碘化钠) | | |
| ④ | 苯 (苯酚) | | |
I.已知:TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g) △H=+140kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1
写出TiO2和焦炭、氯气反应生成液态TiCl4和CO气体的热化学方程式: 。
II.将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
则可以判断该分解反应已经达到平衡状态的是 。
A.2v正(NH3)=v逆(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
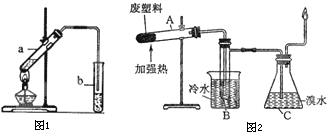
III.以丙烷为燃料制作新型燃料电池,电解质是熔融碳酸盐。电池的一极通入O2和CO2,电极反应式为:O2+2CO2+4e-=2CO32-;另一极通入丙烷,电极反应式为 ;放电时,CO32-移向电池的 (填“正”或“负”)极。
IV.如图装置所示,C、D、E、F都是惰性电极,甲、乙中溶液的体积和物质的量浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。

⑴若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
⑵现用丙装置作“铜的电解精炼”,则H应该是 。(填“纯铜”或“粗铜”)。
⑶上图甲装置电解CuSO4溶液一段时间后,向所得溶液中加入0.2mol Cu(OH)2后,恰好使溶液恢复到电解前的浓度。则乙装置中,若不考虑Cl2的溶解及与碱的反应,此装置共产生气体 L(标准状况)。
 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)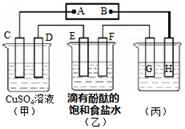
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com